封面图:硝酸铅溶液和碘化钾溶液都是无色的,但两者混合会产生金黄色的碘化铅沉淀。沉淀反应是本章学习的三类反应之一。/©Peng Luyao
普通化学涉及的大多数反应是水溶液中进行的,反应物均匀地分散在溶剂——水中。水将溶质限制在溶液中,有利于进行定量操作。因此很多化学分析方法在水溶液中进行,我们在本章将学习水溶液中常见的三类反应:沉淀反应、酸碱反应和氧化还原反应。这三类反应在化学分析中... 阅读更多
封面图:硝酸铅溶液和碘化钾溶液都是无色的,但两者混合会产生金黄色的碘化铅沉淀。沉淀反应是本章学习的三类反应之一。/©Peng Luyao
普通化学涉及的大多数反应是水溶液中进行的,反应物均匀地分散在溶剂——水中。水将溶质限制在溶液中,有利于进行定量操作。因此很多化学分析方法在水溶液中进行,我们在本章将学习水溶液中常见的三类反应:沉淀反应、酸碱反应和氧化还原反应。这三类反应在化学分析中均有重要用途。
我们来想象一下分子层次下的水溶液是什么样的。水是溶剂,水溶液中绝大多数分子是水分子。溶质微粒通常要少得多,这些微粒分散在水分子之间,如下图所示:

某些溶质在水中以离子的形式存在,离子水溶液的重要性质是导电性。因为离子可以独立地移动,每个离子都带有一定数量的电荷。类似的,金属导体中(如铜和铁)的电子携带电荷,并独立移动。下图说明了离子水溶液导电的方式:
 向溶液中插入两根石墨棒,并连接电源的正负极。在电压的作用下,右边的电极具有更高的电势,因此阳离子从右往左移动,阴离子从左往右移动。
向溶液中插入两根石墨棒,并连接电源的正负极。在电压的作用下,右边的电极具有更高的电势,因此阳离子从右往左移动,阴离子从左往右移动。
 向溶液中插入两根石墨棒,并连接电源的正负极。在电压的作用下,右边的电极具有更高的电势,因此阳离子从右往左移动,阴离子从左往右移动。
向溶液中插入两根石墨棒,并连接电源的正负极。在电压的作用下,右边的电极具有更高的电势,因此阳离子从右往左移动,阴离子从左往右移动。
水溶液是否导电取决于溶质的性质。纯水只含有极少量的离子,因此纯水不导电。但某些溶质溶解后能产生离子,从而使溶液成为电导体。溶解后产生离子的溶质称为电解质 (elecyrolyte)。而不能产生离子的溶质称为非电解质 (nonelecyrolyte)。电解质在水中都能产生离子,但它们在产生离子的趋势并非完全相同。强电解质 (strong elecyrolyte) 是一种在水溶液中几乎完全电离的物质:几乎所有溶解的溶质都以离子形式存在。弱电解质 (weak elecyrolyte) 在水溶液中仅部分电离:只有部分溶解的溶质转化为离子。
通过测量溶液的电导能力可以检测离子的数量。等浓度的非电解质、弱电解质和强电解质溶液与一个灯泡串联并加同样的电压,有三种可能的现象:
 从左往右依次是氯化钠、氨和甲醇的水溶液(颜色仅用于区分),下方是溶质微粒的示意图。将溶液和灯泡并联,并加相同的电压。氯化钠在水中完全电离形成钠离子和氯离子,溶液导电能力最强,灯泡发出亮光。氨在水中部分电离,产生铵根和氢氧根,溶液具有一定导电能力,灯泡微亮。甲醇在水中不电离,灯泡不亮。
从左往右依次是氯化钠、氨和甲醇的水溶液(颜色仅用于区分),下方是溶质微粒的示意图。将溶液和灯泡并联,并加相同的电压。氯化钠在水中完全电离形成钠离子和氯离子,溶液导电能力最强,灯泡发出亮光。氨在水中部分电离,产生铵根和氢氧根,溶液具有一定导电能力,灯泡微亮。甲醇在水中不电离,灯泡不亮。
 从左往右依次是氯化钠、氨和甲醇的水溶液(颜色仅用于区分),下方是溶质微粒的示意图。将溶液和灯泡并联,并加相同的电压。氯化钠在水中完全电离形成钠离子和氯离子,溶液导电能力最强,灯泡发出亮光。氨在水中部分电离,产生铵根和氢氧根,溶液具有一定导电能力,灯泡微亮。甲醇在水中不电离,灯泡不亮。
从左往右依次是氯化钠、氨和甲醇的水溶液(颜色仅用于区分),下方是溶质微粒的示意图。将溶液和灯泡并联,并加相同的电压。氯化钠在水中完全电离形成钠离子和氯离子,溶液导电能力最强,灯泡发出亮光。氨在水中部分电离,产生铵根和氢氧根,溶液具有一定导电能力,灯泡微亮。甲醇在水中不电离,灯泡不亮。
通常来说,几乎所有的可溶性离子化合物和少数的分子化合物是强电解质。大多数分子化合物要么是弱电解质,要么是非电解质。
电解质通过两种过程之一在溶液中产生离子——解离和电离。尽管这两个术语经常混用,但它们的含义略有不同。解离 (dissociation) 指一个实体分离成两个或多个实体,例如过氧化氢解离形成两个羟基自由基 (HO·)。而电离 (ionization) 指原子或分子形成离子的过程。简而言之,严格地说:离子化合物通过解离在溶液中产生离子,而分子化合物通过电离在溶液中产生离子。上节最后的一张图描述了氯化钠固体在水中的解离和乙酸分子 CH3COOH 在水中的电离的微观层次的示意图。
离子化合物由正离子和负离子组成,通常按一定规律重复排列,如下图的氯化钠晶体。随着 NaCl 溶解,离子彼此分离并被水分子包围。被水分子包围的离子被称为水合的。离子固体溶解形成水合离子的过程最好称为解离,离子最初就存在于固体中,随着固体溶解,它们彼此分离。
 氯化钠是一种离子化合物,由钠离子和氯离子组成。水是极性分子——氧是富电子的 (δ−),而氢是缺电子的 (δ+)。氯化钠溶于水,解离出来的钠离子被富电子的的氧包围,而氯离子被缺电子的氢包围,形成水合离子。
氯化钠是一种离子化合物,由钠离子和氯离子组成。水是极性分子——氧是富电子的 (δ−),而氢是缺电子的 (δ+)。氯化钠溶于水,解离出来的钠离子被富电子的的氧包围,而氯离子被缺电子的氢包围,形成水合离子。
 氯化钠是一种离子化合物,由钠离子和氯离子组成。水是极性分子——氧是富电子的 (δ−),而氢是缺电子的 (δ+)。氯化钠溶于水,解离出来的钠离子被富电子的的氧包围,而氯离子被缺电子的氢包围,形成水合离子。
氯化钠是一种离子化合物,由钠离子和氯离子组成。水是极性分子——氧是富电子的 (δ−),而氢是缺电子的 (δ+)。氯化钠溶于水,解离出来的钠离子被富电子的的氧包围,而氯离子被缺电子的氢包围,形成水合离子。
离子化合物 NaCl 的解离是完全的,反应可用下列方程式表示:
有水的存在下,NaCl 的式单位完全解离成单个的离子。因此 NaCl(aq) 最好表示成 Na+(aq) + Cl−(aq)。
分子化合物电离的情况稍微复杂一些,因为分子化合物不由离子组成。通常分子化合物与水发生反应,产生离子。以下方程式表示 CH3COOH 在水中的电离:
双箭头 ⇌ 表示反应进行不完全,因此 CH3COOH 是弱电解质。在 CH3COOH 溶液中,CH3COOH 分子是主要的存在形式,CH3COOH 仅部分发生电离。这说明电离反应是高度可逆的:大多数 H3O+ 和 CH3COO− 离子形成后,会重新结合为 CH3COOH 和 H2O。CH3COO− 和 H3O+ 的浓度远低于 CH3COOH。因此 CH3COOH 溶液应该表示为 CH3COOH(aq),而不是 H3O+(aq) + CH3COO−(aq) 或 H+(aq) + CH3COO−(aq)。
出现在方程式中的 H3O+ 称为水合氢离子,它是水分子和一个裸露的质子结合而成的。水合氢离子能够和周围的水分子继续作用,形成其他物质,如 H5O2+、H7O3+、H9O4+ 等等。很多时候我们简单的将 H3O+ 记为 H+,那么方程式可以写成:
上述方程均表示 CH3COOH 在水中的电离。第一个方程是更合理的,其强调电离这一过程有水参与,且 H+ 离子牢固地与水分子结合。
最后来考虑非电解质的水溶液,因为非电解质在溶液中不会电离,所以非电解质,如 CH3OH 的溶液应该表示为 CH3OH(aq)。
在 0.00500 M MgCl2 溶液中,我们知道 MgCl2(aq) 几乎完全解离为 Mg2+(aq) 和 Cl−(aq)。每个 MgCl2(aq) 解离形成一个 Mg2+ 和两个 Cl−。所以溶液中 Mg2+ 的浓度为 0.0050 M,而 Cl− 的浓度是 0.0100 M。我们用括号 [] 表示溶液中某物种的浓度,例如 [Mg2+] = 0.0050 M,而 [Cl−] = 0.0100 M。
例题
硫酸铝 Al2(SO4)3 是一种强电解质。0.0165 M Al2(SO4)3 中铝离子和硫酸根的浓度是多少?
解答
1 mol 硫酸铝电离产生 2 mol铝离子和 3 mol硫酸根,因此 [Al3+] = 0.0330 M,[SO42−] = 0.0495 M。
练习
海水可近似看作含 0.438 M NaCl 和 0.0512 M MgCl2 的溶液。海水中 Cl− 的浓度是多少?
某些盐(如 NaCl)易溶于水,而另一些盐(如 AgCl)几乎不溶于水。只有极少数的 AgCl 能溶解在水中,因此通常我们认为 AgCl 是不溶的。某些阳离子和阴离子结合产生不溶性离子固体时,就会发生沉淀反应 (precipitation reaction)。沉淀反应在实验室中可用于检测某些离子的存在,例如用硝酸银检测卤素离子。
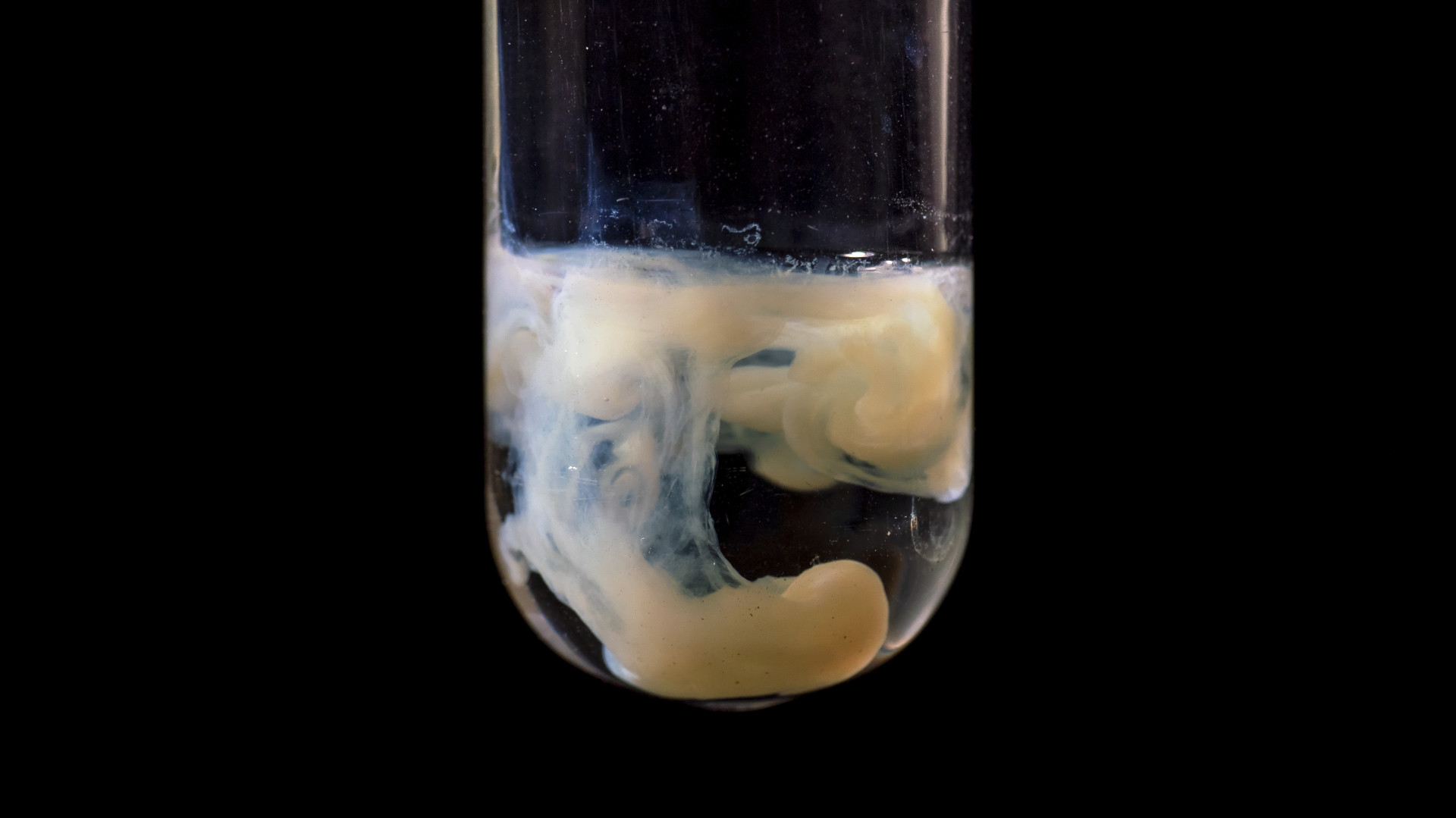 硝酸银滴入碘化钠溶液中产生淡黄色的碘化银沉淀。氯化银、溴化银和碘化银都是难溶于水的沉淀,利用银离子和卤素的沉淀反应可判断卤素是否存在。/©Peng Luyao
硝酸银滴入碘化钠溶液中产生淡黄色的碘化银沉淀。氯化银、溴化银和碘化银都是难溶于水的沉淀,利用银离子和卤素的沉淀反应可判断卤素是否存在。/©Peng Luyao
在工业中,沉淀反应用于制造多种化学品。例如从海水中提取金属镁时,第一步是将 Mg2+ 沉淀为 Mg(OH)2。本节你将学习如何用化学方程式表示沉淀反应,并通过简单的规则了解哪些离子间会发生沉淀反应。
硝酸银和碘化钠在水溶液中反应生成硝酸钠溶液和淡黄色的碘化银沉淀,我们可以写出反应方程式:
刚刚提到可溶性离子化合物——AgNO3、NaI 和 NaNO3——这些强电解质的水溶液最好写成离子的形式:
注意等式左右两边同时出现了 Na+(aq) 和 NO3−(aq)。这些离子不是反应物,它们在反应中没有变化,因此被称为旁观离子 (spectator ion)。消去等式两边的旁观离子,剩下的就是净离子方程式 (net ionic equation):
净离子方程式仅包括反应的实际参与物,物质都用最能代表它的符号或公式表示。净离子方程式的电荷也是平衡的,等式两边必须出现相同的净电荷。在本章的其余部分,我们将用净离子方程表示水溶液中的大多数化学反应。
你一定想知道混合两种盐的溶液能否产生沉淀,例如硝酸银和氯化钠溶液。结果只有两种可能:要么一些阳离子-阴离子结合形成不溶性固体——沉淀。要么不存在这种组合,没有反应发生。我们需要记住常见的沉淀,组成不溶性离子化合物的正负离子在水中相遇时产生沉淀。一个简要的判断规则如下,如果规则之间冲突,序号小的优先。
根据规则,硝酸银和氯化钠溶液会产生氯化银沉淀,因为规则 3 优先于规则 4。反应的净离子方程式为:
例题
预测混合如下溶液能否发生反应。如果可以,写出净离子方程式。
- NaOH(aq) + MgCl2(aq) →
- BaS(aq) + CuSO4(aq) →
- (NH4)2SO4(aq) + ZnCl2(aq) →
解答
碱土金属氢氧化物是微溶的,因此 Mg(OH)2 是沉淀。硫化铜也是不溶的,第二个反应会产生沉淀,而且是两种沉淀。硫酸锌和氯化铵都是可溶的,第三个反应不产生沉淀。
Mg2+(aq) + 2 OH−(aq) → Mg(OH)2(s) Cu2+(aq) + SO42−(aq) + Ba2+(aq) + S2−(aq) → CuS(s) + BaSO4(s) 练习
预测下面的反应能否产生沉淀,可以的话写出净离子方程式。
- KOH(aq) + AlCl3(aq) →
- BaS(aq) + ZnSO4(aq) →
- Na3PO4(aq) + AlCl3(aq) →
在古代人们就已经有了对酸和碱的概念。酸 (acid) 来源于拉丁语 acidus(酸味)。碱 (alkali, base) 来自阿拉伯语 al-qali,指草木灰,可以从中提取碱性物质。酸碱概念是化学史上的一个重要主题。在本节中我们主要学习斯万特·阿伦尼乌斯 (Svante Arrhenius, 1859-1927) 于 1884 年提出的观点。另外本节简单介绍了马丁·劳里 (Thomas Martin Lowry, 1874-1936) 和约翰内斯·布仑斯惕 (Johannes Brønsted, 1879-1947) 在 1923 年提出的更现代的理论。
可通过多种方法识别酸,包括尝味道(不过不要在化学实验室中这么做)、利用酸和碳酸盐的反应以及通过酸碱指示剂的颜色来判断。甲基红是一种酸碱指示剂,它在酸性环境下呈红色,否则为黄色。
 甲基红在酸性条件下为红色(左),碱性条件下为黄色(右图)。在特定的弱酸性溶液中呈橙色的中间色(中)/©LHcheM CC BY-SA 3.0
甲基红在酸性条件下为红色(左),碱性条件下为黄色(右图)。在特定的弱酸性溶液中呈橙色的中间色(中)/©LHcheM CC BY-SA 3.0
站在化学家的视角,酸可以定义为在水溶液中电离产生氢离子的物质。这是斯万特·阿伦尼乌斯于 188 年提出的定义。有强烈电离的酸(强电解质),也有微弱电离的酸(弱电解质)。强酸 (strong acid)在水中几乎完全电离产生氢离子和阴离子。盐酸 (HCl) 和硝酸 (HNO3) 是常见的强酸。HCl 在水中的电离可用下式表示:
同样的,HNO3 溶解在水中时,会完全电离为 H+ 和 NO3−。常见的强酸只有数个:HCl、HBr、HI、HClO4、HNO3、H2SO4。(硫酸分两步电离,只有第一步电离是完全的,见 16-6 节)
弱酸 (weak acid) 是产生离子倾向较弱的分子化合物,弱酸在水溶液中电离不完全。大多数酸是弱酸,弱酸的电离用可逆反应来描述。例如乙酸 CH3COOH 的电离反应可以表示为:
你可能想知道到底有多少比例的 CH3COOH 发生了电离,这一问题目前对你而言过于困难,我们会在第 16 章学习。阿伦尼乌斯理论认为酸电离产生氢离子和阴离子,但事实并非如此。1923 年丹麦的约翰内斯·布仑斯惕和英国的马丁·劳里分别独立地提出,决定酸(和碱)性质的关键过程是质子(H+离子)从一个物质转移到另一种物质。例如我们已知道 CH3COOH 的电离反应方程式可以写成:
乙酸是质子给体 (proton donor),而水分子是质子受体 (proton acceptor)。
水是否作为反应物写在方程式中是一个偏好问题。你可以不写水分子,然后氢离子写成 H+ 的形式。但你必须意识到,氢离子不是自由的,而是水合的。也有些人喜欢在反应物中加入 H2O,强调酸的电离是质子转移的过程。
我们可以通过碱的苦味、溜滑的手感(因为碱会水解皮肤表面的油脂)和酸碱指示剂来识别碱。阿伦尼乌斯定义碱是在水溶液中产生氢氧根和阳离子的物质。例如可溶性的离子氢氧化物 NaOH。NaOH 固体由 Na+ 和 OH− 离子组成。当固体溶于水时,离子解离:
NaOH 的解离是完全的,因此它是强碱 (strong base)。NaOH(aq) 最好表示为 Na+(aq) + OH−(aq)。和强酸一样,常见的强碱不多,主要是碱金属和碱土金属的氢氧化物:LiOH、NaOH、KOH、RbOH、CsOH、Mg(OH)2、Ca(OH)2、Sr(OH)2、Ba(OH)2。
某些物质通过与水反应产生 OH−,这些物质也是碱。例如氨的电离:
该反应不能进行完全,只有部分 NH3 电离,因此氨是弱电解质。电离不全的碱是弱碱 (weak base),大多数碱性物质都是弱碱。
我们也可以用布仑斯惕-劳里理论来看这一方程。水作为质子给体将 H+ 转移给了氨,氨在反应中是质子受体。
我们已经知道,酸溶于水产生 H+,碱溶于水产生 OH−。然而实验发现,即使在纯水中也存在少量的 H+ 和 OH−。纯水可以发生如下反应,这一反应进行的程度非常有限:
精准的测量表明,25 °C 下 [H+]w = [OH−]w = 1.0×10−7 M(下标 w 表示仅适用于纯水)。因为酸电离产生 H+,因此酸性溶液的 [H+] > 1.0×10−7 M。而碱性溶液 [OH−] > 1.0×10−7 M。也就是说:
我们会在第 16 章进一步学习这些关系式。
酸和碱最重要的特征或许是它们能相互抵消(中和)对方的特征。在中和反应 (neutralization reaction) 中,酸和碱反应生成盐 (salt) 的水溶液。例如强酸 HCl 和强碱 NaOH 的反应:
去掉旁观离子后的净离子方程展示了强碱中和强酸的根本性质:酸的 H+ 和碱的 OH− 结合形成水。
如果中和反应中的酸或碱是弱的,情况有点不同:
乙酸是弱酸,CH3COOH 不应该拆开为 CH3COO− 和 H+。因此净离子方程应该写成:
反应中 CH3COOH 是酸而 OH− 是碱,乙酸的质子转移到 OH− 上形成水。
另一个类似的例子是强酸和弱碱的反应,例如盐酸和氨水:
反应的净离子方程:
在这个反应中,NH3 作为碱接受来自 HCl 的质子,形成 NH4+。强酸强碱同弱碱弱酸的反应是基本完全的,因此不需要使用 ⇌ 。
酸含有可电离的氢原子。通常书写方程式的时候,可电离的H原子与分子式中的其他H原子分开,以强调不同。方法是将它们写在分子式中的首位,或指出它们在分子中的位置。例如乙酸的化学式可写成 HC2H3O2 或 CH3COOH。甲烷 CH4 有四个 H 原子,但它们均不可电离,因此甲烷既不是酸也不是碱。
分子式表示为 OH− 与阳离子组合的物质通常是强碱,例如 NaOH。通常弱碱不能简单通过化学式识别,而需要考虑它们电离反应的方程式。目前我们只需知道氨是一种弱碱。注意,乙醇 CH3CH2OH 不是碱,乙醇不能电离为 CH3CH2+ 和 OH−。OH 在乙醇中是羟基而不是氢氧根。
Mg(OH)2 在水中的溶解度很低,Mg(OH)2 悬浮液称为氧化镁乳液,是一种中和胃酸的药物。溶解在水中的少量 Mg(OH)2 电离产生 OH−,乳液遇到酸,酸会和这些 OH− 形成水。使得更多的 Mg(OH)2 溶解,然后被更多的酸中和。Mg(OH)2 与强酸反应的净离子方程为:
氢氧化镁也可以和弱酸反应,例如乙酸溶液。只要乙酸的量足够多,所有的 Mg(OH)2 都会溶解:
碳酸钙,CaCO3 是石灰石和大理石的主要成分,碳酸钙可溶于强酸和弱酸。碳酸钙中含有碳酸根离子 CO32−,它能和氢离子结合形成碳酸 H2CO3。碳酸很不稳定,它分解为水和二氧化碳。因此碳酸钙和强酸反应的净离子方程如下:
酸雨会腐蚀大理石雕像,反应产生二氧化碳气体。这一反应也是实验室获得二氧化碳的方法。碳酸钙和氧化镁一样,也被用于抗酸剂。
 酸雨对大理石雕像有毁灭性的破坏。大理石主要成分是 CaCO3,酸雨可以通过化学反应溶解大理石。/©Nino Barbieri CC BY 2.5
酸雨对大理石雕像有毁灭性的破坏。大理石主要成分是 CaCO3,酸雨可以通过化学反应溶解大理石。/©Nino Barbieri CC BY 2.5
阿伦尼乌斯对碱的定义只承认 OH− 是碱。在第 16 章我们更加深入地学习酸和碱的时候,我们会发现现代理论扩充了碱的定义。例如 CO32− 也可以看成是碱。下表列出了一些常见的能够和 H+ 或 OH− 反应产生气体的离子:
| 离子 | 反应方程式 |
|---|---|
| HSO3− | HSO3− + H+ → SO2 + H2O |
| SO32− | SO32− + 2 H+ → SO2 + H2O |
| HCO3− | HCO3− + H+ → CO2 + H2O |
| CO32− | CO32− + 2 H+ → CO2 + H2O |
| S2− | S2− + 2 H+ → H2S |
| NH4+ | NH4+ + OH− → NH3 + H2O |
例题
写出反应的净离子方程式:硝酸和氢氧化锶溶液反应,盐酸和氢氧化铝固体反应。
解答
硝酸是强电解质,氢氧化锶也是强电解质。第一个反应的净离子方程式为:
H+(aq) + OH−(aq) → H2O(l) 盐酸是强电解质,氢氧化铝是固体。反应产物氯化铝和水,氯化铝是强电解质。因此反应净离子方程式为:
Al(OH)3(s) + 3 H+(aq) → Al3+(aq) + 3 H2O(l) 练习
碳酸钙是水垢的主要成分,可以用白醋擦拭除去。写出反应的净离子方程式。
氧化还原反应是人类最早掌握的化学反应。从火的使用到金属冶炼,氧化还原反应在人类史上扮演了重要的作用。人类加热铜矿石和木炭的混合物,开启了青铜时代的序幕。铁矿石和木炭的反应需在更高的温度下进行,但铁矿的高含量、铁的硬度使得铁器很快取代了青铜,人类历史进入铁器时代。不同文明生产铁的方式大同小异:在高炉中将铁矿石和碳加热,简化的反应方程式如下:
我们可以认为,CO 夺取了 Fe2O3 的氧原子,产生 CO2。失去了氧原子的 Fe2O3 变为铁单质。我们常用氧化 (oxidation) 来表示物质获得 O 原子的过程,而物质失去 O 原子的过程是还原 (reduction)。上述反应中 CO 被氧化,Fe2O3 被还原。氧化和还原必定同时发生,这种反应称为氧化还原反应 (redox reaction)。另一种从 Fe2O3 中获得铁单质的方法是点燃 Fe2O3 和 Al 粉的混合物。该反应称为铝热反应 (thermite reaction),非常剧烈和壮观。反应释放出大量的热量,甚至能使铁熔化。铁路工人用粉末状的 Fe2O3 和铝的混合物生产用于焊接铁轨的铁水。
 铝粉和氧化铁的混合物发生铝热反应,产生烈焰和火星。/©Kingfisher CC BY-SA 3.0
铝粉和氧化铁的混合物发生铝热反应,产生烈焰和火星。/©Kingfisher CC BY-SA 3.0
氧化还原反应并不仅限于氧原子的转移,而有着更加广泛的定义。很多氧化还原反应不涉及氧原子。
我们在第三章学习了氧化态的定义,考虑高炉炼铁反应中的氧化态变化。所有的 O 都是 −2 价,其他元素的氧化态如下:
铁和碳的氧化态的发生了变化,铁从 Fe2O3 的 +3 减少至单质 Fe 的 0。碳从一氧化碳中的 +2 增加到 CO2 的 +4。因此发生氧化的元素,氧化态增加;发生还原的元素,氧化态降低。尽管氧化态是对某个元素而言的,但整个化合物都可以说氧化或还原。Fe2O3 被还原,而 CO 被氧化。
例题
指出下面的反应是否是氧化还原反应。如果是,何种物质被氧化,何种物质被还原。
MnO2(s) + 4 H+(aq) + 2 Cl−(aq) → Mn2+(aq) + 2 H2O(l) + Cl2(g) H2PO4−(aq) + OH−(aq) → HPO42−(aq) + H2O(l) 解答
第一个反应,Mn 的氧化态从 +4 降低到 +2,而 Cl 的氧化态从 −1 升高至 0。因此是氧化还原反应,MnO2 被还原,Cl− 被氧化。
第二个反应没有发生氧化态的变化,它是酸碱反应。
练习
指出下面的反应是否是氧化还原反应。如果是,何种物质被氧化,何种物质被还原。
2 Pb(NO3)2(s) → 2 PbO(s) + 4 NO2(g) + O2(g) 5 VO2+(aq) + MnO4−(aq) + H2O(l) → 5 VO2+(aq) + Mn2+(aq) + 2 H+(aq)
将锌片插入硫酸铜溶液中,锌片的表面产生一层红棕色的铜单质(在最初生成的时候是黑色的)。该反应的净离子方程如下:
 锌片插入硫酸铜溶液中,发生反应得到红棕色铜单质/©Peng Luyao
锌片插入硫酸铜溶液中,发生反应得到红棕色铜单质/©Peng Luyao
我们可以通过氧化数的变化判断反应是否是氧化还原反应。氧化还原反应的另一个特征是,反应可以拆成同时发生的两个半反应 (half-reaction)——氧化和还原。总反应是两个半反应的总和。我们可以用半方程表示半反应,用总方程表示总反应:
在氧化半反应中,Zn 被氧化。其氧化态从 0 增加到 +2,因此每个锌原子失去两个电子。在还原半反应中,Cu 被还原。其氧化态从 +2 降低到 0,因此每个 Cu2+ 离子获得两个电子。总结如下:
需要强调,我们只是在形式上将氧化还原反应分解为涉及失去电子和获得电子的半反应。电子转移并不一定是正确的,很多氧化还原反应不涉及得失电子。例如这个反应:
该反应当然是氧化还原反应,因为N的氧化态从 +3 变为 +5,而 Cl 的氧化态从 +1 变为 −1。但分子层次上的反应步骤并不涉及电子 HClO 到 NO2− 的转移,我们可以写出反应的半反应方程式:
这两个半反应都不是真实发生的,实际上反应通过氧原子转移进行。
例题
铁粉溶于盐酸生成 Fe2+ 和氢气。写出净离子方程,以及两个半反应方程式。
解答
反应中 Fe 氧化数从 0 变为 +2,被氧化。H 氧化数从 +1 变为 0,被还原。
氧化: Fe(s) → Fe2+(aq) + 2 e− 还原: 2 H+(aq) + 2 e− → H2(g) 总反应: Fe(s) + 2 H+(aq) → Fe2+(aq) + H2(g) 练习
氯气通入溴化钠溶液,得到液溴和氯化钠。写出净离子方程,以及两个半反应方程式。
在做上一个例题的时候你可能会有疑问:为何铁溶于盐酸得到 Fe2+ 而不是 Fe3+?为何铁能溶于盐酸而铜不可以?这些问题我们会留到第 19 章解答,但现在你应该已能看出答案和氧化还原的能力有关:Fe 比 Cu更容易被氧化,Fe 生成 Fe2+ 比生成 Fe3+ 的半反应还原性更强。你现在只需要记住常见金属在水溶液中的活动性顺序:
在氢前的元素单质可以与酸(甚至是水)反应产生氢气,氢之后的金属无法与非氧化性酸反应。在前面的金属可以将后面的金属离子水溶液置换出来,例如 Zn 可以和 Cu2+ 溶液反应。
化学反应中,原子既不产生也不消失:它们只是重新排列。我们在第 4 章利用这个想法配平化学反应方程式。而氧化还原反应中,需要额外考虑氧化态的变化。可以想象:电子从一种物质转移到另一种物质,因此氧化态升高失去的电子必定与氧化态降低得到的电子数相同。配平氧化还原反应方程式时,关注三个因素:(1) 各元素的原子数;(2) 转移的电子数;(3) 反应物和产物的总电荷。事实上,只要前两个配平了,方程就自动配平了总电荷数。我们首先考虑以下反应,每个反应似乎都是平衡的:
上述方程均满足因素 (1),但只有一个方程式是正确的,因为它也满足因素 (2)。尽管有多种方法配平氧化还原方程,本节主要学习如何单独书写半反应方程,然后将两个半反应合并以获得总方程。
通过半反应方程配平氧化还原方程的步骤如下:
首先我们考虑如何配平酸性溶液中的半方程,酸性溶液含有过量的 H+ 离子,它将会在半反应方程式中出现。
例题
配平如下不完整的方程式:
SO32−(aq) + MnO4−(aq) → SO42−(aq) + Mn2+(aq) 解答
反应中 S 氧化数从 +4 变为 +6,被氧化。Mn 氧化数从 +7 变为 +2,被还原。写出被氧化(还原)的物质,以及它们转化得到的产物:
SO32−(aq) → SO42−(aq) MnO4−(aq) → Mn2+(aq) 第二步配平除了 H 和 O 外的元素,方程式已经配平了 S 和 Mn。第三步首先用水配平氧元素,方程如下:
SO32−(aq) + H2O(l) → SO42−(aq) MnO4−(aq) → Mn2+(aq) + 4 H2O(l) 然后再用 H+ 配平氢元素:
SO32−(aq) + H2O(l) → SO42−(aq) + 2 H+(aq) MnO4−(aq) + 8 H+(aq) → Mn2+(aq) + 4 H2O(l) 第一个反应发生 S 的氧化,S 失去 2 个电子。第二个反应发生 Mn 的还原,Mn 得到 5 个电子。现在给方程式添上电子:
SO32−(aq) + H2O(l) → SO42−(aq) + 2 H+(aq) + 2 e− MnO4−(aq) + 8 H+(aq) + 5 e− → Mn2+(aq) + 4 H2O(l) 反应的电荷和已配平,说明结果是正确的。两个方程式分别乘以系数 5 和 2,并加和,即得到总方程:
5 SO32− + 2 MnO4− + 6 H+ → 5 SO42− + 2 Mn2+ + 3 H2O 练习
配平如下不完整的方程式:
Fe2+(aq) + MnO4−(aq) → Fe3+(aq) + Mn2+(aq) UO2+(aq) + Cr2O72−(aq) → UO22+(aq) + Cr3+(aq)
配平碱性溶液中的氧化还原方程要比酸性溶液多一两个步骤。碱性溶液含有较多 OH− 离子,OH− 和 H2O 均可出现在最终的方程式中。因为 OH− 和 H2O 两者都包含 H 和 O 原子,有时很难确定两者在半方程的哪侧。一种简单的方法是首先写出酸性溶液中的反应方程,并按照前述方法配平。然后在整个氧化还原方程的每一侧加上与 H+ 相等的 OH− 离子。如果 H+ 和 OH− 出现在等式的同一侧,它们组合为 H2O。如果 H2O 现在出现在方程的两边,则消去多余的 H2O。例题如下:
例题
碱性条件下 MnO4− 的还原产物通常是 MnO2。配平如下不完整的方程式:
MnO4−(aq) + CN−(aq) → MnO2(s) + OCN−(aq) 解答
首先假定反应在酸性条件下进行,那么反应方程式为:
2 MnO4− + 3 CN− + 2 H+ → 2 MnO2 + 3 OCN− + H2O 左右两边各加两个 OH−,OH− 和左边的 H+ 生成 H2O:
2 MnO4− + 3 CN− + 2 H2O → 2 MnO2 + 3 OCN− + H2O + 2 OH− 消除一个 H2O,最终的方程式为:
2 MnO4− + 3 CN− + H2O → 2 MnO2 + 3 OCN− + 2 OH− 练习
配平如下不完整的碱性条件下反应的方程式:
S(s) + OCl−(aq) → SO32−(aq) + Cl−(aq) MnO4−(aq) + SO32−(aq) → MnO2(s) + SO42−(aq)
有一些特殊的氧化还原反应,同一种物质既被氧化又被还原,被称为歧化反应 (disproportionation reaction)。 例如过氧化氢分解为 H2O 和 O2:
反应中,氧的氧化态从 −1 变为 −2(还原)和 0(氧化)。H2O2 既被氧化又被还原。歧化反应的另一个例子是硫代硫酸根在酸中的分解反应:
硫代硫酸根中 S 的氧化数为 +2,在反应中歧化为 0 以及 +4。硫代硫酸钠溶液是一种常见的试剂,但我们不会长期储存硫代硫酸钠溶液,因为放置过久它会分解产生淡黄色的硫沉淀。
歧化反应也可以写出半反应方程式,硫代硫酸根分解的半反应为:
氧化剂和还原剂是描述氧化还原反应中某些反应物的术语,例如『氟气是一种强氧化剂』、『金属钙是一种很好的还原剂』。在氧化还原反应中,能使某些物质被氧化的物质称为氧化剂 (oxidizing agent/oxidant)。反应中氧化剂本身被还原。能使某些物质被还原的物质称为还原剂 (reducing agent/reductant),在反应中还原剂本身被氧化。氧化剂和还原剂相关的内容总结如下:
| 氧化剂 | 还原剂 |
|---|---|
| 氧化别的物质 | 还原别的物质 |
| 反应中氧化态降低 | 反应中氧化态升高 |
| 获得电子,电子处半方程左侧 | 失去电子,电子处半方程右侧 |
| 被还原 | 被氧化 |
氮的氧化态可以 −3 取到 +5,典型的物质如下:
| +5 | +4 | +3 | +2 | +1 | 0 | −1 | −2 | −3 |
|---|---|---|---|---|---|---|---|---|
| NO3− | N2O4 | NO2− | NO | N2O | N2 | NH2OH | N2H4 | NH3 |
通常,元素处高氧化态时是氧化剂,处于低氧化态的时候是还原剂。因此 N2O4 通常是氧化剂,而肼,N2H4 通常是还原剂。这两种液体化合物混合时,会发生剧烈的反应:
这一反应会放出大量的热,以及产生大量气体,因此可用于火箭的推进系统。尽管 N2H4 通常是还原剂,但N的氧化态并未处于最低状态,因此还是可以被还原的:
高锰酸根是常用的氧化剂,它是一种深紫色的离子。下一节我们会学习高锰酸钾法定量分析亚铁离子,即确定含铁材料中铁有多少。臭氧是氧的同素异形体,是饮用水的一种消毒剂。另一种用于饮用水消毒的氧化剂是二氧化氯,ClO2。次氯酸钠也是一种含氯的消毒剂,是 84 消毒液的主要成分。NaClO 具有强氧化性,能将一些色素分子氧化为无色物质,可用于漂白。
硫代硫酸钠是常见的还原剂,其工业用途包括除去纸浆中的残留氯:
很多生命反应涉及氧化还原反应,例如光合作用(利用太阳能合成葡萄糖)和呼吸作用(氧化糖类提供能量)。
例题
过氧化氢既可以作氧化剂使用,也可以作还原剂使用。指出过氧化氢在如下反应中的角色:
H2O2 + 2 Fe2+ + 2 H+ → 2 H2O + 2 Fe3+ 5 H2O2 + 2 MnO4− + 6 H+ → 8 H2O + 2 Mn2+ + 5 O2 解答
反应 1 中 Fe 从 +2 变为 +3 价,故 H2O2 作氧化剂使用。而反应 2 中 Mn 从 +7变 为 +2 价,故 2O2 作还原剂使用。
练习
指出下列反应中的氧化剂和还原剂:
2 NO2 + 7 H2 → 2 NH3 + 4 H2O 4 Au + 8 CN− + O2 + 2 H2O → 4 [Au(CN)2]− + 4 OH−
如果我们的目标是以尽可能低成本的获得产品,我们通常会让最贵的反应物作为限量反应物,而其他反应物过量。大多数沉淀反应属于这种类型。但在某些情况下,我们对反应产物不感兴趣,而对两种反应物之间的定量关系感兴趣。此时我们希望两种反应物都不过量——它们是化学计量比的。具体操作的方法称为滴定 (titration),滴定使用的主要玻璃仪器如图所示:
 用氢氧化钠滴定盐酸,以酚酞作为指示剂。滴定到终点,溶液由无色变为浅粉红色。带旋塞阀和刻度的玻璃仪器是滴定管,其可以定量测量有多少氢氧化钠溶液进入下面的锥形瓶中。/©Kengksn CC BY-SA 4.0
用氢氧化钠滴定盐酸,以酚酞作为指示剂。滴定到终点,溶液由无色变为浅粉红色。带旋塞阀和刻度的玻璃仪器是滴定管,其可以定量测量有多少氢氧化钠溶液进入下面的锥形瓶中。/©Kengksn CC BY-SA 4.0
一种反应物的溶液(在图中是盐酸)在烧杯或烧瓶中。另一种反应物的溶液(在图中是氢氧化钠)称为滴定剂 (titrant),加入到滴定管 (buret)——一个带有旋塞阀的长刻度管。通过操纵旋塞,将第二种溶液缓慢加入到第一种溶液中。在两种反应物恰好完全反应时停止滴定,此时称为滴定的等当点 (equivalence point)。在等当点时,两种反应物以化学计量比发生反应,两者同时反应完全,且都没有过量。
现代化学实验室中通过仪器来确定是否达到等当点。但称为指示剂 (indicator) 的物质仍被广泛使用。将极少量合适的指示剂加入反应混合物中,在非常接近等当点的时候会产生颜色变化。这里的指示剂是酚酞,它在弱碱性溶液中呈粉色。一旦氢氧化钠略微过量,就会让溶液变为淡粉色,达到滴定终点 (end point)。
假设需要获得一瓶摩尔浓度非常精确的 KMnO4 溶液,且浓度接近 0.020 M。我们无法通过称量精确质量的 KMnO4 固体并将其溶解在水中来制备该溶液。因为 KMnO4 固体的不纯的,且纯度(即 KMnO4 质量百分数)未知。但铁丝可以非常纯净的形式购买,称量一定质量的铁丝,与酸反应生成 Fe2+。Fe2+ 在酸性溶液中用 KMnO4 氧化生成 Fe3+。KMnO4 滴定 Fe2+ 不需要额外加入指示剂,因为 MnO4− 具有非常深的紫色,少量过量的 MnO4− 会让溶液变为淡粉色,表明达到滴定终点。通过铁丝的质量和 KMnO4 体积,我们可计算出 KMnO4 溶液的精确摩尔浓度。此过程称为标定 (standardization),我们通过铁丝标定了高锰酸钾溶液,获得了精确的摩尔浓度。
例题
醋是碳水化合物通过细菌发酵产生的稀乙酸水溶液。法律规定白醋中乙酸最低含量为 4%(按质量计)。醋的密度约为 1.01 g mL−1,用 0.1000 M NaOH 溶液滴定 5.00 mL 醋样品,消耗 38.08 mL。该样品是否合格?
解答
乙酸和 NaOH 1:1 反应,反应消耗 3.808 mmol NaOH,因此乙酸的物质的量为 3.808 mmol,质量为 0.2287 g。醋的质量为 5.05 g,因此乙酸的质量分数为 4.53%,符合规定。
练习
氢氧化钠溶液可通过邻苯二甲酸氢钾 (KHC8H4O4) 进行标定。称取 0.5000 g 邻苯二甲酸氢钾,溶于水后用氢氧化钠溶液滴定,消耗 24.03 mL。计算氢氧化钠溶液的浓度。
例题
称取 0.1568 g 铁丝,溶于酸后用未知浓度 KMnO4溶液滴定,消耗 26.24 mL。计算 KMnO4 的浓度。
解答
Fe2+ 和 KMnO4 按 5:1 进行反应。Fe 的物质的量为 2.808 mmol,因此 KMnO4 的物质的量为 0.5615 mmol。由此可知 KMnO4 的浓度为 0.02140 M。
练习
KMnO4 溶液也可用草酸钠 (Na2C2O4) 进行标定。称取 0.2482 g Na2C2O4,溶于水后酸化溶液,用 KMnO4 滴定,消耗 23.68 mL。已知反应中 Na2C2O4 被氧化为 CO2。请写出反应的净离子方程,并计算 KMnO4 的浓度。