封面图:蜂蜜中果糖结晶的偏振显微图像。果糖是一种在很多植物中存在的酮糖,它与葡萄糖结合形成蔗糖。果糖、葡萄糖和蔗糖都是常见的化合物,这些分子由多种元素结合而成。/©ZEISS Microscopy CC BY-NC-ND 2.0
水、一氧化碳、二氧化碳⋯⋯这些物质都是相当简单的化合物,它们由两种元素组成。当然也有复杂的化合物,如白糖(蔗糖)、维生素 C(抗坏血酸)、明矾(水合硫酸铝钾)。绝大多数我们接触的化学物质是化合物,在本章我们将学习化合物的有关知识。化合物的特点是由两种或... 阅读更多
封面图:蜂蜜中果糖结晶的偏振显微图像。果糖是一种在很多植物中存在的酮糖,它与葡萄糖结合形成蔗糖。果糖、葡萄糖和蔗糖都是常见的化合物,这些分子由多种元素结合而成。/©ZEISS Microscopy CC BY-NC-ND 2.0
水、一氧化碳、二氧化碳⋯⋯这些物质都是相当简单的化合物,它们由两种元素组成。当然也有复杂的化合物,如白糖(蔗糖)、维生素 C(抗坏血酸)、明矾(水合硫酸铝钾)。绝大多数我们接触的化学物质是化合物,在本章我们将学习化合物的有关知识。化合物的特点是由两种或... 阅读更多
封面图:蜂蜜中果糖结晶的偏振显微图像。果糖是一种在很多植物中存在的酮糖,它与葡萄糖结合形成蔗糖。果糖、葡萄糖和蔗糖都是常见的化合物,这些分子由多种元素结合而成。 /©ZEISS Microscopy CC BY-NC-ND 2.0
水、一氧化碳、二氧化碳⋯⋯这些物质都是相当简单的化合物,它们由两种元素组成。当然也有复杂的化合物,如白糖(蔗糖)、维生素 C(抗坏血酸)、明矾(水合硫酸铝钾)。绝大多数我们接触的化学物质是化合物,在本章我们将学习化合物的有关知识。化合物的特点是由两种或多种元素组成,我们可以将化合物分为几大类:分子化合物、离子化合物等。化合物通常通过化学式来表示,化学式由化合物组成的元素衍生而来。在本章中我们将学习化学式的书写方法,以及化学式能给我们提供的信息。本章最后概述了称呼各类化学物质的方法——化学命名法。
在化合物中,多个元素的原子通过化学键 (chemical bond) 结合在一起。根据化学键的类型,化合物被分为四种类型。
金属互化物和络合物将在后面的章节学习。本章我们只需要了解分子化合物和离子化合物的基本特征,而化学键将在第 10 章和第 11 章学习。
分子化合物是由一个个分子组成的,分子通常包含短周期非金属元素。分子化合物可以用化学式 (chemical formula) 表示,化学式是用化学符号表示特定分子或化合物的化学比例信息的方式,通过化学式我们可以得知物质包含的元素及相对比例。
水的化学式是 H2O,下标表示原子个数,即水分子中含两个氢原子。下标 1 会被省略,因此我们不会将水写成 H2O1。甲醛的化学式是 CH2O,甲醛由碳、氢、氧三种元素组成。水和甲醛都是分子化合物,化学式同时表示物质本身和分子组成。
最简的化学式被称为经验式 (empirical formula),经验式中的下标简化为最简整数比。例如磷的某种氧化物的经验式为 P2O5,而分子的化学式是 P4O10。经验式只能告诉我们有限的信息,例如甲醛 (CH2O)、乙酸 (C2H4O2) 的最简式都是 CH2O,我们无从得知经验式为 CH2O 的物质是什么。
分子式 (molecular formula) 基于化合物的实际分子组成,乙酸分子由两个碳、四个氢和两个氧组成,分子式为 C2H4O2。分子式和经验式不包含有关分子结构的信息。甲酸甲酯的分子式也是 C2H4O2,它和乙酸并不是同一物质。
结构式 (structual formula) 包含原子在分子中成键顺序和成键类型的信息。乙酸和甲酸甲酯的结构式如下所示,可以看出原子的成键顺序并不相同。


画出复杂分子的结构式是非常繁复的,而结构简式 (condensed structual formula) 提供了一种简便但仍能显示原子如何连接的方法。乙酸可表示为 CH3COOH 或 CH3CO2H,而甲酸甲酯可表示为 HCOOCH3 或 CH3OCHO。另一个例子是丁烷和异丁烷,它们的分子式都是 C4H10。丁烷的结构简式是 CH3CH2CH2CH3,而异丁烷的结构简式是 CH3CH(CH3)CH3 或 CH(CH3)3。


上述物质是有机化合物,有机化合物通常含有碳元素和氢元素,很多天然的有机化合物含有氧元素和/或氮元素。有机化合物可能非常复杂,即使书写结构简式也较为繁复。简化结构式的另一种办法是省略碳原子和氢原子的符号。在键线式 (line-angle formula)中,线代表化学键,碳原子在线的末端或两线相交的地方,并默认每个碳形成四根化学键,如果不够则用氢原子代替。而非碳原子及其上面的氢原子会被明确地写出。
分子具有体积,结构是三维的。结构式虽然包含空间排布的信息,但不能直观表示分子的形状。只有三维模型才能令人满意地表示出分子立体结构。在球棍模型 (ball-and-stick model) 中,原子用不同的小球表示,而化学键用细棍表示。这一模型可以告诉我们分子几何形状及原子的相对距离(键长)。
而空间填充模型 (space-filling model) 与球棍模型的区别在于,空间填充模型中原子大小是『全尺寸』的。模型中的原子彼此接触,这一模型的优点是展现了分子的有效形状。但模型也掩盖了原子之间的化学键,且背面的原子通常会被遮挡。
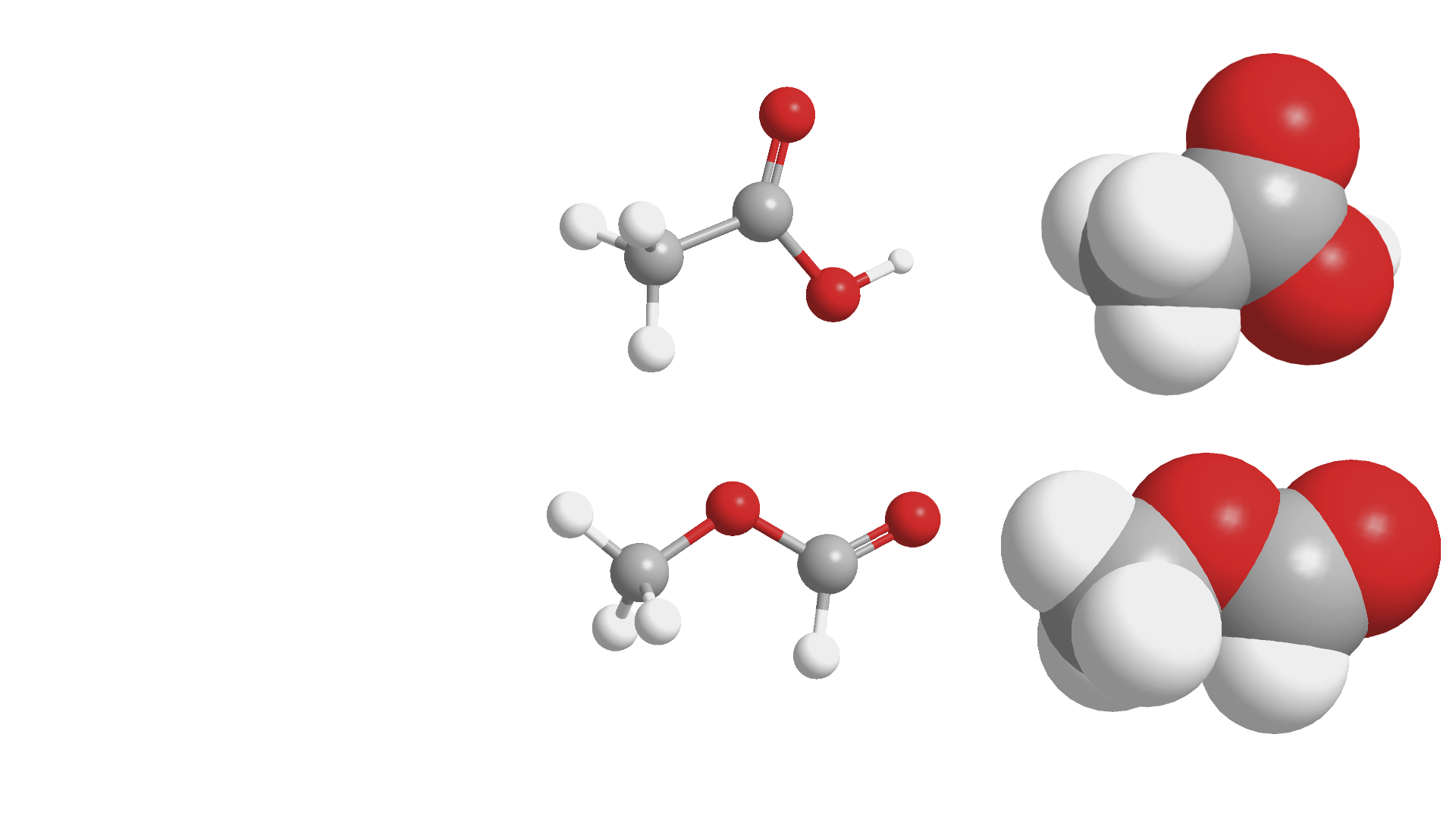 乙酸(上)和甲酸甲酯(下)的结构式(左)、球棍模型(中)和空间填充模型(右)。这两个分子由三种类型的原子组成,不同的颜色用于区分不同原子。有色球体的大小并不相同,对应于元素周期表中各种原子之间的大小差异。此外,与氧原子相连的氢的性质与其他氢不太一样,特意使用较小的体积标记。
乙酸(上)和甲酸甲酯(下)的结构式(左)、球棍模型(中)和空间填充模型(右)。这两个分子由三种类型的原子组成,不同的颜色用于区分不同原子。有色球体的大小并不相同,对应于元素周期表中各种原子之间的大小差异。此外,与氧原子相连的氢的性质与其他氢不太一样,特意使用较小的体积标记。
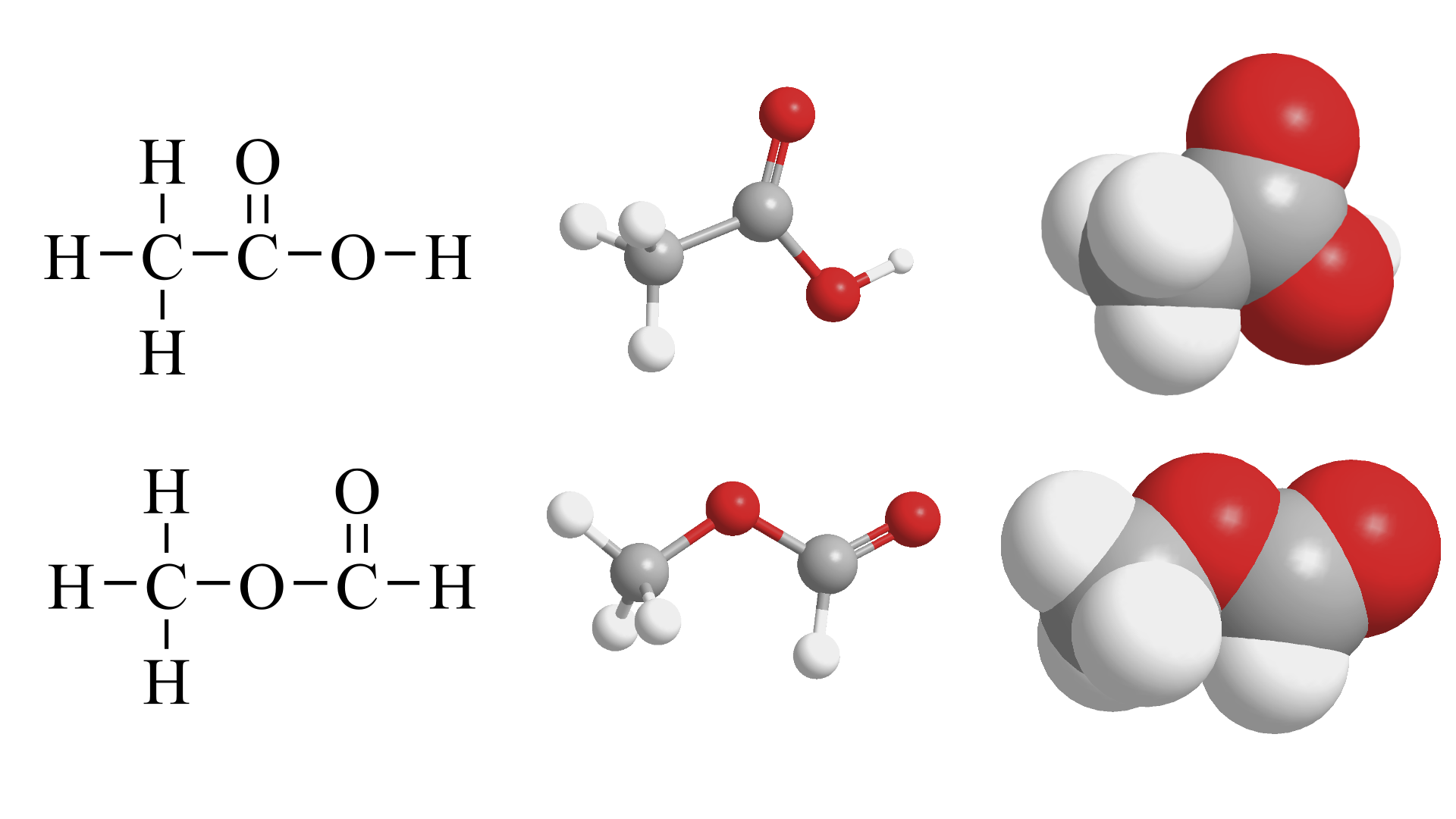 乙酸(上)和甲酸甲酯(下)的结构式(左)、球棍模型(中)和空间填充模型(右)。这两个分子由三种类型的原子组成,不同的颜色用于区分不同原子。有色球体的大小并不相同,对应于元素周期表中各种原子之间的大小差异。此外,与氧原子相连的氢的性质与其他氢不太一样,特意使用较小的体积标记。
乙酸(上)和甲酸甲酯(下)的结构式(左)、球棍模型(中)和空间填充模型(右)。这两个分子由三种类型的原子组成,不同的颜色用于区分不同原子。有色球体的大小并不相同,对应于元素周期表中各种原子之间的大小差异。此外,与氧原子相连的氢的性质与其他氢不太一样,特意使用较小的体积标记。
金属元素和非金属元素结合通常得到离子化合物。离子化合物由阳离子 (cation 和阴离子 (anion) 通过静电引力结合而成(回想一下 2.2 节关于电荷的内容)。在反应中,金属原子通常失去一个或多个电子,而非金属原子通常获得一个或多个电子。由于电子发生转移,金属原子变为阳离子,而非金属原子变为阴离子。在第 2.6 节我们学过,我们可以通过主族元素所在的族推测阳离子或阴离子的电荷。例如氟和钙反应生成氟化钙,这一物质是种天然的矿石,被称为萤石。氟是第 17 族元素,因此其获得一个电子得到 F− 离子。而第 2 族的钙失去两个电子得到 Ca2+ 离子。化合物整体是电中性的,每存在一个 Ca2+ 必定存在两个 F−,故钙离子和氟离子比例是 1:2。
离子化合物的式单位 (formula unit) 是最小的电中性离子集合,氟化钙的化学式写作 CaF2,其结构如图所示。每个钙离子周围有八个氟离子,每个氟离子周围有四个钙离子(图中未完全显示)。离子之间通过静电引力形成网络结构,式单位不作为独立的实体存在,因此将离子化合物的式单位称为分子式是不合适的。
 氟化钙的晶胞结构,蓝球表示钙离子,绿球表示氟离子。式单位是最小的电中性离子集合。橙色虚线围住的立方体是晶胞,晶胞是晶体的重复单元,是空间上的概念而不是实际存在的物体。我们会在第 12 章学习晶体。
氟化钙的晶胞结构,蓝球表示钙离子,绿球表示氟离子。式单位是最小的电中性离子集合。橙色虚线围住的立方体是晶胞,晶胞是晶体的重复单元,是空间上的概念而不是实际存在的物体。我们会在第 12 章学习晶体。
 氟化钙的晶胞结构,蓝球表示钙离子,绿球表示氟离子。式单位是最小的电中性离子集合。橙色虚线围住的立方体是晶胞,晶胞是晶体的重复单元,是空间上的概念而不是实际存在的物体。我们会在第 12 章学习晶体。
氟化钙的晶胞结构,蓝球表示钙离子,绿球表示氟离子。式单位是最小的电中性离子集合。橙色虚线围住的立方体是晶胞,晶胞是晶体的重复单元,是空间上的概念而不是实际存在的物体。我们会在第 12 章学习晶体。
钙离子 Ca2+、钠离子 Na+、氟离子 F− 是简单离子,只由一个原子组成。而多原子离子由两个或多个原子构成。硝酸根化学式是 NO3−,表示三个氧原子和一个氮原子通过共价键连接形成单个离子 NO3−。硝酸镁是硝酸根和镁离子形成的离子化合物,为确保电中性,镁离子和硝酸根的比例为 1:2。硝酸镁的化学式中的硝酸根用括号括起,并用下标 2 表示数量,因此写作 Mg(NO3)2。多原子离子将在 3.6 节进一步讨论。
通过化合物的化学式可以确定它的式量 (formula mass)。式量是以原子质量单位表示的式单位的质量,式量这一属于对于任何化合物都是适用的。对于分子化合物,化学式是实际的分子,此时可以使用分子量 (molecular mass),即以原子质量单位表示的分子质量
只需将原子质量相加即可获得式量或分子量。一般情况下,使用四位有效数字的原子质量精度足矣。对于水 H2O 而言,分子质量为 18.015 u。氟化钙 CaF2 的式量是 78.08 u。而硝酸镁 Mg(NO3)2 的式量是 148.313 u。
我们可以将摩尔的概念用于任何微观物体——原子、离子、分子,甚至电子、质子等。一摩尔任何微粒含有阿伏伽德罗常量个式单位或分子数。而摩尔质量 (molar mass) 是 1 mol 化合物的质量。碳-12 原子的摩尔质量几近于 12 g,在一般精度下可认为等于 12 g(因为物质的量的定义有修改,详见 2.7 节)。因此 1 mol 物质的质量(以克为单位)数值上等于该物质的式量,例如 1 mol Mg(NO3)2 = 148.313 g Mg(NO3)2 = 6.02214×1023 个镁离子以及两倍数量的硝酸根。
物质的量、质量和微粒数量的转换是非常基础的内容,尤其是物质的量和质量之间的相互转换。两者以摩尔质量为桥梁联系起来。
例题
分析天平能够检测的质量下限是 0.1 mg,那么最小可检测量的 Mg(NO3)2 中含有多少个离子?
解答
0.1 mg Mg(NO3)2 的物质的量是 0.1×10−3 ÷ 148.31 = 6.747×10−7 mol,而 1 mol Mg(NO3)2 中含有 3 mol 个离子。故离子数是 6.747×10−7 × 6.02214×1023 × 3 = 1.2×1018。
练习
金的密度是 19.32 g cm−3,一块边长 2.50 cm,厚度 0.100 mm 的金箔含有多少个金原子?
例题
乙硫醇 C2H6S 是气味最重的物质之一,天然气中常常加有乙硫醇,以便在泄露时能及时发现。1.0 μL 的乙硫醇样品中含有多少个分子?乙硫醇的密度是 0.84 g mL−1。
解答
1.0 μL 乙硫醇的质量是 8.4×10−4 g,因此物质的量为 8.4×10−4 ÷ 62.138 =1.35×10−5 mol。故含有 1.35×10−5 × 6.02214×1023 = 8.1×1018 个分子。
练习
乙硫醇被嗅出的检测限度是 9×10−4 μmol m−3,那么 1 μL 乙硫醇均匀扩散到长宽高为 20 m × 10 m × 3 m 的教室中,能否被嗅出?
在第二章中,我们将 1 mol 元素看成 6.02214×1023 个原子,例如 1 mol S = 6.022×1023 S 原子 = 32.07 g 硫。对于多数金属而言,这种说法没有问题,因为金属由大量球形原子聚集而成,就像罐子里的弹珠一样。但有些元素单质是由有限个原子组成的分子构成,S8 和 P4 的结构如下图所示。其他你需要掌握的例子包括 H2、O2、N2、F2、Cl2、Br2、I2。
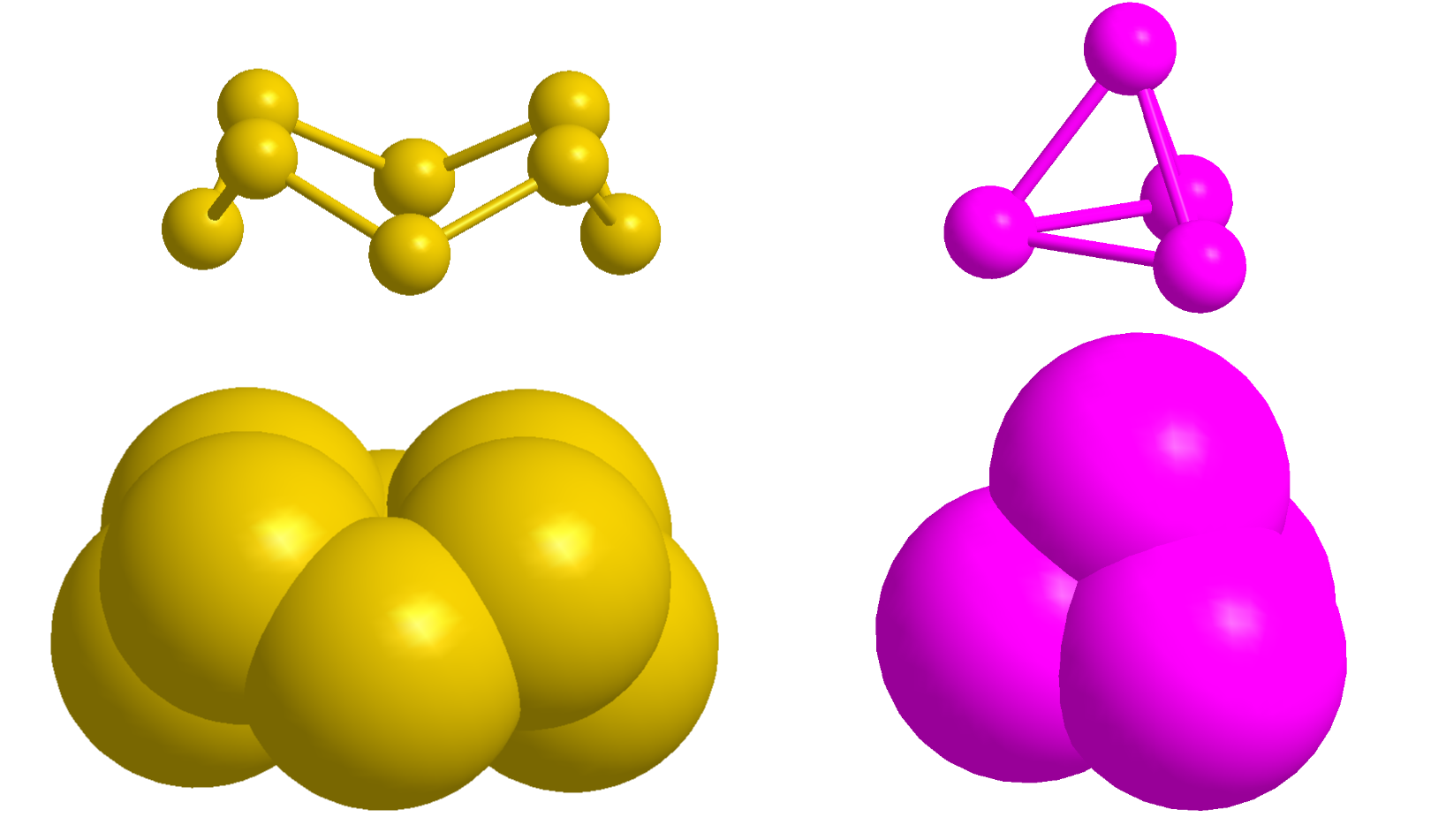 硫黄和白磷中的分子分别为 S8 和 P4,两者的分子均含有多个原子。S8 是皇冠形的分子,而 P4 具有正四面体结构。
硫黄和白磷中的分子分别为 S8 和 P4,两者的分子均含有多个原子。S8 是皇冠形的分子,而 P4 具有正四面体结构。
对于这些元素,摩尔质量可以用两种方式表示。以 S8 为例,硫的原子质量是 32.07 g mol−1,而 S8 的分子质量是 256.56 g mol−1。
另一种情况是某些元素以多种分子的形式存在,这种现象称为同素异形 (allotropy)。例如氧可以形成常见的氧气分子 O2,也可以形成臭氧分子 O3。氧气的摩尔质量是 31.998 g mol−1,而臭氧的摩尔质量是 47.997 g mol−1
通过化学式我们可以获得化合物的元素组成信息,还是以硝酸镁 Mg(NO3)2 为例,1 个式单位包含一个镁离子和两个硝酸根,即 1 Mg(NO3)2 ~ 1 Mg2+ ~ 2 NO3−。也可以说 1 个式单位包含 2 个氮原子和 6 个氧原子,即 1 Mg(NO3)2 ~ 2 N ~ 6 O。因此每 mol Mg(NO3)2 包含 2 mol 氮原子和 6 mol 氧原子,类似的转换关系在题目中经常出现。
例题
硝酸镁的密度是 2.31 g cm−3,25.0 cm3 的硝酸镁固体中含有多少个氧原子?
解答
25.0 cm3 的硝酸镁质量是 25.0 × 2.31 = 57.8 g,相当于 57.8 ÷ 148.313 = 0.389 mol Mg(NO3)2,因此其中含有 0.389 × 6 = 2.34 mol 氧原子,即 2.34 × 6.02214×1023 = 1.41×1024 个氧原子。
练习
体积为 100 cm3 的硝酸镁晶体中含有多少质量的氮?
当化学家认为自己合成了一种新物质时,通常会对样品进行元素分析 (elemental analysis),即确定含有的元素及百分含量。通过将实验结果与通过预期的化学式计算得到的百分含量进行比较,可以确定产物是否符合预期。元素的百分含量通过如下步骤计算得到:
以计算硝酸镁 Mg(NO3)2 的氮含量为例,其式量为 148.313 g mol−1。一个式单位含有 2 个氮原子,因此氮的质量分数为:$\frac{14.01\times 2}{148.313}\times 100\%=18.89\%$。
显而易见,物质所含的元素的质量分数之和为 100%。如果我们知道某种元素之外其他元素的质量分数,用 100% 减去其他元素质量分数就能得到该元素的质量分数。
例题
计算硝酸镁中氧和镁的质量分数,验证物质所含的元素的质量分数之和为 100%。
解答
Mg(NO3)2 的氧含量是 6 × 16.00 ÷ 148.313 × 100% = 64.73%;镁含量是 24.30 ÷ 148.313 × 100% = 16.38%。三者之和为 18.89% + 64.73% + 16.38% = 100%。
练习
氟烷 (fluothane) 是一种含有溴吸入性全身麻醉剂,化学式为 C2HBrClF3。计算氟烷中卤素的总质量分数。
你现在发现了一种未知的化合物,并通过元素分析获得了有关元素的质量分数,很多时候这些信息足矣确定其化学式。我们以化合物 2-脱氧核糖为例,2-脱氧核糖是 DNA(脱氧核糖核酸)的组成成分,2-脱氧核糖的元素分析结果为:44.77% C、7.52% H 和 47.71% O。获得化学式的步骤如下:
实际的分子式应当是经验式的某个整数倍,例如 C10H20O8 等。通过质谱可以获得分子的质量,实验确定 2-脱氧核糖的分子量为 134 u,因此其分子式 C5H10O4,与经验式相同。
例题
琥珀酸二丁酯是一种驱虫剂,用于杀死家中的蚂蚁和蟑螂。其组成为 62.58% C、9.63% H 和 27.79% O。实验确定其分子量为 230 u。琥珀酸二丁酯的经验式和分子式是什么?
解答
假定碳有 1 mol,按照上面的步骤按部就班可以得出该物质 C:H:O = 1:1.83:0.33 = 6:11:2,因此经验式为 C6H11O2。但我们可以直接用分子量乘以质量分数再除以原子量,以碳为例:230 × 62.58% ÷ 12.01 = 11.98。通过这种方法可以直接得出分子式:C12H22O4。
练习
山梨糖醇是一种低热量的甜味剂,分子量为 182 u,含有 39.56 wt% 的碳和 7.74 wt% 的氢,剩下的元素是氧。山梨糖醇的分子式是什么?
燃烧分析 (combustion analysis) 是一种常用于有机化合物元素分析的方法。在燃烧分析中,已知质量的化合物样品在氧气流中燃烧。燃烧产生的水蒸气和二氧化碳被适当的物质吸收,吸收剂增加的质量等于水和二氧化碳的质量。
 燃烧分析实验装置示意图:氧气流依次通过炉中的样品、盛有高氯酸镁的容器、盛有氢氧化钠的容器。更为现代的燃烧分析是通过光谱方法进行的,红外光谱可直接测量产物中二氧化碳和水蒸气的含量。
燃烧分析实验装置示意图:氧气流依次通过炉中的样品、盛有高氯酸镁的容器、盛有氢氧化钠的容器。更为现代的燃烧分析是通过光谱方法进行的,红外光谱可直接测量产物中二氧化碳和水蒸气的含量。
 燃烧分析实验装置示意图:氧气流依次通过炉中的样品、盛有高氯酸镁的容器、盛有氢氧化钠的容器。更为现代的燃烧分析是通过光谱方法进行的,红外光谱可直接测量产物中二氧化碳和水蒸气的含量。
燃烧分析实验装置示意图:氧气流依次通过炉中的样品、盛有高氯酸镁的容器、盛有氢氧化钠的容器。更为现代的燃烧分析是通过光谱方法进行的,红外光谱可直接测量产物中二氧化碳和水蒸气的含量。
燃烧后,有机物中所有的碳原子都转化为 CO2,所有的氢原子转化为 H2O,且碳和氢唯一的来源是样品。CO2 和 H2O 中的氧可能部分来源于样品,部分来自于反应消耗的氧气。因此氧含量不是直接通过元素分析获得的。
例题
维生素 C 参与人体合成胶原蛋白的生物途径,因此缺乏维生素 C 会导致坏血病。燃烧 0.2000 g 维生素 C 的样品会产生 0.2998 g CO2 和 0.0819 g H2O。维生素 C 仅由 C、H、O 组成,其经验式是什么?
解答
0.2998 g CO2 含有 0.08181 g C,因此维生素 C 的碳含量是 40.91%。同理,维生素 C 的氢含量是 4.58%,由于维生素 C 仅由 C、H、O 组成,因此氧含量是 100% − 40.91% − 4.58% = 54.51%。假定碳的物质的量是 1 mol,那么物质的量之比 C:H:O = 1:1.33:1.000。其经验式为 C3H4O3。
练习
燃烧 1.505 g 噻吩——一种含硫的有机化合物,得到 3.149 g CO2、0.645 g H2O 和 1.146 g SO2。噻吩的经验式是什么?
并非所有的样品都能燃烧,例如很多卤代烃是不可燃的。这些时候我们会使用其他的分析方法。现代的分析实验室更多依靠仪器的物理测量而不是化学反应,有关仪器分析的部分内容会在后续课程中学习。
化学中大多数科学概念涉及可观测的物理量或现象,但少数情况下人们会引入没有任何物理基础的概念。氧化态(氧化数,oxidation state/number)就属于这种情况。简单来说,如果原子所成的键都是离子性的,那么其所带的电荷就是氧化数。以离子化合物 NaCl 为例,钠原子失去一个电子,而氯获得一个电子。因此 Na+ 处于 +1 氧化数,Cl− 处于−1 氧化数。而 MgCl2 中 Mg 失去两个电子形成 Mg2+,氧化数为 +2。而 Cl 的氧化数是 −1。氯化镁化学式中所有原子的氧化数之和为 0。
在 Cl2 分子中,两个 Cl 原子是等同的,其具有相同的氧化数。假定 Cl2 的总氧化数为 0,那么每个 Cl 的氧化数都为 0。因此元素有多种可能的氧化数,取决于具体的化合物。而在 H2O 分子中,我们假定 H 的氧化数为 +1,如果化合物中总氧化数为 0,那么 O 的氧化数为 −2。
由此可以看出,氧化数是根据一些人为规定所分配的。确定氧化数的规则非常复杂,因为化合物的种类繁多,经常有一些例外出现,需要额外指定规则以完善整个体系。我们现在只需要掌握一些经验性、且通常适用的7条规则。如果规则之间相互冲突,优先满足低序号的规则。
单个原子或单质的氧化数为 0。
例:单质汞中,Hg 的氧化数为 0;Cl2 中 Cl 的氧化数为 0。
电中性物种总原子氧化数之和为 0,而离子的氧化数之和等于电荷数。
例:MgCl2 中原子的氧化数之和为 0,而 Fe3+ 中 Fe 的氧化数为 +3。
第 1 族金属(碱金属)氧化数为 1,而第 2 族元素(碱土金属)氧化数为 2。
NaH 中 Na 的氧化数为 +1;CaCO3 中 Ca 的氧化数为 +2。
化合物中,氟的氧化数为 −1。
例:OF2 中 F 的氧化数为 −1。
化合物中,氢的氧化数基本为 +1。
例:H2O2 中 H 的氧化数为 +1。
化合物中,氧的氧化数基本为 −2。
例:KMnO4 中 O 的氧化数为 −2。
含金属的二元化合物中,第 17 族元素氧化数为 −1,第 16 族元素氧化数为 −2,第 15 族元素氧化数为 −3。
例:Li3N 中 N 的氧化数为 −3。
例题
指出以下物种中各元素的氧化数是多少:P4、MnO4−、NaH、H2O2、OF2、Fe3O4。
解答
P4 是磷的单质,故 P 的氧化数为 0;
MnO4− 中 O 的氧化数为 −2,而所有原子氧化数之和为 −1,因此 Mn 的氧化数为 +7;
NaH 中 Na 的氧化数为 +1,H 的氧化数为 −1;
H2O2中 H 的氧化数为 +1,O 的氧化数为 −1;
OF2 中 F 的氧化数为 −1,O 的氧化数为 +2;
在 Fe3O4 中,O 的氧化数为 −2,Fe 的氧化数为 $+\frac{8}{3}$。
练习
指出以下物种中各元素的氧化数是多少:S8、S2O32−、S4O62−、Hg2Cl2、KO2。
Fe3O4 中铁的氧化数为 $+\frac{8}{3}$ 有些令人疑惑。非整数的氧化数是确实存在的,例如 O2− 离子中 O 的氧化数为 −0.5。但在 Fe3O4 中,是由于 Fe 存在不同氧化数的原子。Fe3O4 可以写成 Fe2O3·FeO。FeO 中 Fe 的氧化数为 +2,而 Fe2O3 中 Fe 的氧化数为 +3。两种表述方法都可以,取决于使用何者更为方便。
另一个类似但不完全相同的例子是 NH4NO3,尽管我们可以按照上述规则将N的氧化数定为 +1,但实际上 NH4NO3 是由离子 NH4+ 和 NO3− 组成的。因此 N 的氧化数为 −3 和 +5,多数情况下使用单个 N 原子的氧化态比使用平均氧化态更有用。
化合物种类繁多,很多化合物有俗名或商品名,例如维生素 C、扑热息痛、明矾等。我们不可能给每一个物质都取一个俗名,这样我们需要学习数百万个不相关的名字。因此必须要有一套系统的命名方法,在这套方法中类似的化合物有着类似的名称。
有多套命名系统,处理不同种类的化合物。有机化合物有自己的命名规则,多肽、多糖、核酸等多聚物也有一套独特的命名方法。我们只需掌握简单的无机化合物及有机化合物的命名方法。
二元化合物 (binary compound) 是两种元素形成的化合物。如果一种元素是金属,另一种是非金属,该化合物通常是离子化合物,即二元离子化合物。命名金属和非金属形成的二元化合物时,先写出非金属的元素名,在元素名后加『化』,然后写出金属的元素名。
例如 NaCl、MgI2 和 Al2O3 分别叫作:氯化钠、碘化镁和氧化铝。由于氧离子带 −2 的电荷,铝离子带 +3 的电荷,要保证化合物的总氧化数为 0,氧和铝的比例一定是 3:2。
一些金属可能会形成多种离子,从而形成多种不同的化合物,因此命名的时候必须将其区分开来。铁可以形成两种常见的离子,第一种是 Fe2+,称为铁(II)离子或亚铁离子。第二种是 Fe3+,称为铁(III)离子或铁离子。对应的氯化物,FeCl2 称为氯化亚铁或二氯化铁或氯化铁(II)。而 FeCl3 称为氯化铁或三氯化铁或氯化铁(III)。
亚铁离子、亚铜离子中的亚表示比常见的氧化数更低的状态,因此亚铜离子指的是 Cu+。而高表示氧化数更高的状态,例如高氯酸钾 KClO3。这种方法有几个缺点,因此 IUPAC 推荐的系统命名不使用亚铁这样的名称。
| 离子 | 名称 | 名称 | 离子 | 名称 | 名称 |
|---|---|---|---|---|---|
| Cr3+ | 铬离子 | 铬(III)离子 | Sn4+ | 锡离子 | 锡(IV)离子 |
| Cr2+ | 亚铬离子 | 铬(II)离子 | Sn2+ | 亚锡离子 | 锡(II)离子 |
| Fe3+ | 铁离子 | 铁(III)离子 | Hg2+ | 汞离子 | 汞(II)离子 |
| Fe2+ | 亚铁离子 | 铁(II)离子 | Hg22+ | 亚汞离子 | 汞(I)离子 |
| Cu2+ | 铜离子 | 铜(II)离子 | |||
| Cu+ | 亚铜离子 | 铜(I)离子 |
例题 1
写出物质的化学式:硫化钡、氟化钙、磷化铜(II)。
解答 1
硫离子、氟离子和磷离子的氧化数分别是 −2、−1 和 −3,而钡离子、钙离子和铜(II) 离子氧化数均为 +2,因此化学式为 BaS、CaF2 和 Cu3P2。
例题 2
写出物质的名称:Na2S、AlF3、Cu2O。
解答 2
分别为硫化钠、氟化铝、氧化铜(I)。
练习
写出物质的名称:CsI、CrCl3、CaH2、Hg2Cl2。
如果两种非金属形成二元化合物,该化合物通常是分子化合物。分子化合物的命名方法与前类似,例如 HCl 被称为氯化氢,H2S 被称为硫化氢。我们先写出负化合价的元素,因此 HCl 不被称为氢化氯。
一些非金属形成多种二元化合物,需要加以区分。例如硫的常见氧化物包括 SO2 和 SO3,前者被称为二氧化硫,后者被称为三氧化硫。如果两种元素均有多个原子,例如 B2Br4,其被称为四溴化二硼。化合价为正的原子的数量如果为 1,那么『一』可以省略,例如 NO 称为一氧化氮。
一些常见化合物几乎不使用系统命名,例如水——一氧化二氢,氨——一氮化三氢。
HCl 的名称是氯化氢,有些时候我们想强调其水溶液呈酸性,会将其称为某酸。什么是酸会在第 16 章学习,现在你只需知道酸是能在水中电离产生氢离子 H+(实际为水合氢离子)和阴离子的物质。氢酸 (binary acid) 是氢和非金属形成的二元酸性化合物,HCl 在水中电离产生 H+ 和 Cl−,它是一种二元酸。而 NH3 在水中不能电离产生 H+,故 NH3 不是酸。我们用『氢某酸』来命名氢酸,例如氢氯酸、氢硫酸。常见的氢酸包括:HF、HCl、HBr、HI 和 H2S。
除了 Hg22+ 外,其他金属离子是单原子离子。氯离子、溴离子、氧离子也是单原子离子。而多原子离子包含多个原子,原子之间通过共价键连接在一起,这在非金属中非常常见。常见多原子离子的名称、化学式,以及典型化合物的名称如下表所示:
| 名称 | 化学式 | 典型化合物 | 化合物名称 |
|---|---|---|---|
| 铵根/铵离子 | NH4+ | NH4Cl | 氯化铵 |
| 乙酸根 | CH3COO− | NaCH3COO | 乙酸钠 |
| 碳酸根 | CO32− | Na2CO3 | 碳酸钠 |
| 碳酸氢根 | HCO3− | NaHCO3 | 碳酸氢钠 |
| 次氯酸根 | ClO− | NaClO | 次氯酸钠 |
| 亚氯酸根 | ClO2− | NaClO2 | 亚氯酸钠 |
| 氯酸根 | ClO3− | NaClO3 | 氯酸钠 |
| 高氯酸根 | ClO4− | NaClO4 | 高氯酸钠 |
| 铬酸根 | CrO42− | Na2CrO4 | 铬酸钠 |
| 重铬酸根 | Cr2O72− | Na2Cr2O7 | 重铬酸钠 |
| 氰根/氰离子 | CN− | NaCN | 氰化钠 |
| 氢氧根/氢氧离子 | OH− | NaOH | 氢氧化钠 |
| 亚硝酸根 | NO2− | NaNO2 | 亚硝酸钠 |
| 硝酸根 | NO3− | NaNO3 | 硝酸钠 |
| 草酸根 | C2O42− | Na2C2O4 | 草酸钠 |
| 高锰酸根 | MnO4− | NaMnO4 | 高锰酸钠 |
| 磷酸根 | PO43− | Na3PO4 | 磷酸钠 |
| 磷酸(一)氢根 | HPO42− | Na2HPO4 | 磷酸氢二钠 |
| 磷酸二氢根 | H2PO4− | NaH2PO4 | 磷酸二氢钠 |
| 亚硫酸根 | SO32− | Na2SO3 | 亚硫酸钠 |
| 亚硫酸氢根 | HSO3− | NaHSO3 | 亚硫酸氢钠 |
| 硫酸根 | SO42− | Na2SO4 | 硫酸钠 |
| 硫酸氢根 | HSO4− | NaHSO4 | 硫酸氢钠 |
| 硫代硫酸根 | S2O32− | Na2S2O3 | 硫代硫酸钠 |
从上面的表格,我们可以发现一些规律:
大多数酸由三种元素组成,称为三元化合物。其中一种元素一定是氢,若另外的元素含氧,则称其为含氧酸。含氧酸可看成是氢离子和含氧阴离子(酸根)的结合。含氧酸的名字直接把『酸根』改为『酸』即可。酸通常是分子化合物,而盐是离子化合物。
| 氧化数 | 化学式 | 名称 | 盐的化学式 | 名称 |
|---|---|---|---|---|
| Cl : +1 | HClO | 次氯酸 | NaClO | 次氯酸钠 |
| Cl : +3 | HClO2 | 亚氯酸 | NaClO2 | 亚氯酸钠 |
| Cl : +5 | HClO3 | 氯酸 | NaClO3 | 氯酸钠 |
| Cl : +7 | HClO4 | 高氯酸 | NaClO4 | 高氯酸钠 |
| N : +3 | HNO2 | 亚硝酸 | NaNO2 | 亚硝酸钠 |
| N : +5 | HNO3 | 硝酸 | NaNO3 | 硝酸钠 |
| S : +4 | H2SO3 | 亚硫酸 | Na2SO3 | 亚硫酸钠 |
| S : +6 | H2SO4 | 硫酸 | Na2SO4 | 硫酸钠 |
例题
写出物质的名称:ClO2、HBrO4、Ca(H2PO4)2。
解答
名称分别是:二氧化氯、高溴酸、磷酸二氢钙。
练习
写出物质的名称:SF6、HIO、AgClO4、FeSO4。
在上一章提到,约瑟夫·普鲁斯特用碳酸盐沉淀硝酸铜中的铜,得到绿色沉淀。该沉淀的组成和天然矿石孔雀石相同,化学式为 Cu2(OH)2CO3。而在一些药物手册中,同样的化合物被称为碱式碳酸铜,化学式为 CH2Cu2O5。在化学手册中,其被称为碳酸二羟铜(II),化学式为 CuCO3·Cu(OH)2。三种写法是等同的,从任何一个化学式都能得出正确的原子比例。
有些无机盐可以形成水合物 (hydrate),例如硫酸铜常以五水合硫酸铜的形式存在:CuSO4·5H2O。水合物并不是湿的,很多水合物外观和食盐一样,水合物中的水分子不像液态水那样自由。
无水氯化钴是蓝色的固体,吸水后变为粉色的六水合氯化钴 CoCl2·6H2O。一些无水盐可以用作干燥剂,例如氯化钙。CoCl2 很容易失去或吸收水,可以利用这一性质制作简单的湿度计。
 浸有CoCl2 溶液的滤纸,上方的滤纸用热风机吹过,CoCl2 以无水盐的形式存在。下方的滤纸已在空气中放置了一段时间,CoCl2 吸水变为粉色的 CoCl2·6H2O。/©Peng Luyao
浸有CoCl2 溶液的滤纸,上方的滤纸用热风机吹过,CoCl2 以无水盐的形式存在。下方的滤纸已在空气中放置了一段时间,CoCl2 吸水变为粉色的 CoCl2·6H2O。/©Peng Luyao
按种类计的话,绝大多数化合物都是有机化合物,有机化合物也在生活中扮演着重要的地位:食物基本由有机化合物组成,糖类、蛋白质和脂肪是最主要的营养物质。几乎所有的高分子材料都是有机化合物,塑料在生活中随处可见。有机化合物拥有独特的性质,因此单独作为一门二级学科存在。
有机化合物种类繁多与碳的成键能力密不可分,碳通常形成四根化学键,碳原子之间可以相互成键,形成长链或者环状的骨架。碳还可以和其他原子,如氧、硫、氮相连。这些可能性允许形成几乎无数种有机化合物。有机化合物大多数分子化合物,也有少数离子化合物。
复杂的有机化合物的系统名通常是非常冗长、琐碎的。例如蔗糖的系统名为:α-D-吡喃葡萄糖基-β-D-呋喃果糖苷。很多有机化合物有俗名,在普通化学中我们更多的使用俗名而不是系统名。现在只需需要掌握简单有机化合物的系统命名法。
最简单的有机化合物是甲烷 CH4,包含一个碳原子和四个氢原子。由碳和氢组成的二元化合物称为烃 (tīng, hydrocarbon),这个字刚好包含碳中的『火』和氢中的『𢀖』,读音也是碳的声母和氢的韵母组合而成的。烷烃 (alkane) 是只包含单键的烃,下一个成员是乙烷 C2H6,再之后是丙烷 C3H8,以及丁烷 C4H10。每多一个碳,氢原子会增加两个,因此烷烃的通式为 CnH2n+2。
烷烃的名称由两部分组成,词干(前缀)表示碳原子数,十以内(含)用天干(甲乙丙丁戊己庚辛壬癸)表示,超过十直接用中文数字表示。结尾(后缀)是『烷』,例如含八个碳的烷称为辛烷,含十二个碳的烷称为十二烷。
碳原子之间含有一个或多个碳碳双键的烃称为烯烃 (alkene),烯烃的名称需将对应烷烃中的『烷』改成『烯』,如乙烯 (C2H4)、丙烯 (C3H6)。苯 (C6H6) 是一种特殊的环状化合物,很多有机化合物包含与苯相关的结构。


3.1 节提到过丁烷和异丁烷的结构式,它们具有相同的化学式 C4H10,但结构不同。这种现象称为同分异构 (isomerism),这两个分子互称为同分异构体(异构体,isomer)。异丁烷又称为 2-甲基丙烷,其可以看成是甲基 (CH3—) 取代丙烷中的一个氢原子获得的。随着分子变得更为复杂,同分异构体的数量爆发式增长。
例题
判断下面两组分子是否互为同分异构体:
解答
第一组分子化学式分别为 C7H16和C8H18,不属于同分异构体。第二组分子化学式均为 C6H14,但结构不同,属于同分异构体。
练习
判断下面两组分子是否互为同分异构体:
碳链构成有机化合物的骨架,骨架上的氢原子可以被其他原子或原子团取代,从而形成新的化合物。以酒中的乙醇为例,乙醇的化学式为 CH3CH2OH,其可以看成由乙烷中的一个 —H 被 —OH 基团取代得到的。乙醇的名称衍生自乙烷,最后的『烷』改成『醇』。『醇』表示一类含有 —OH 基团的有机化合物。


乙醇的俗名是酒精,乙醇存在于各种酒类中——葡萄酒、米酒、黄酒等。最简单的醇是甲醇,是由甲烷衍生来的。甲醇又叫木醇,因为通过干馏木头可以获得甲醇。甲醇和乙醇结构相似,但甲醇的毒性远高于乙醇。过去有人用掺有甲醇的酒精勾兑白酒,造成多人中毒,严重者会失明甚至死亡。
醇中的—OH基团被称为羟基 (hydroxyl group),羟基是一种官能团 (functional group)。官能团是连接在碳链上,并赋予分子特征的单个原子或原子团。具有相同官能团的物质通常具有相似的性质。在本章我们只需学习几个官能团,更多的官能团会在第 26 章了解。
官能团会增加异构体的数量,例如丙醇是丙烷中的一个氢被羟基取代得到的。有两种可能的取代位置:末端碳上的氢或中间碳上的氢。取代末端碳上的氢得到 1-丙醇,取代中间碳上的氢得到 2-丙醇。1 和 2 表示羟基所在的位置,三个碳的编号依次为 1、2、3。
另一个重要的基团是羧基 (carboxylic group),—COOH 或 —CO2H,带有羧基的分子是酸性的。羧基中的碳同时和两个氧原子相连,但连接方式并不一样。端基氧与碳通过双键连接,而羟基氧与碳通过单键相连。最简单的羧酸是甲酸 HCOOH,又叫蚁酸,因为蚂蚁可以分泌这种化学物质抵御敌害。含有两个碳的羧酸称为乙酸,俗称醋酸。其化学式为 CH3COOH,白醋是乙酸的水溶液。单个的卤素原子也是官能团,烷烃的氢原子被卤素取代得到卤代烃。命名这类化合物时,在母体前面加上对应的卤素的名称,如氯乙酸。


例题
指出下列化合物属于何种类型:
解答
第一个化合物属于烷烃,第二个化合物用氯取代了一个氢,属于卤代烃。第三个化合物包含 —COOH,属于羧酸。第四个化合物包含 —OH,属于醇。
例题
命名化合物:
解答 第一个化合物属于烷烃,含有五个碳原子,为戊烷。第二个化合物用氟取代了丁烷 2 号碳的一个氢,名称为 2-氟丁烷。第三个化合物包含 —COOH,含有三个碳原子,为丙酸。第四个化合物包含 —OH,羟基取代了戊烷的 3 号碳上的氢原子,为 3-戊醇。
例题
画出下列化合物的结构:丁酸、1-氯丙烷、1-己醇。
解答
结构如下: