酸与碱
封面图:柑橘属水果的酸性源于柠檬酸H3C6H5O7,柠檬酸是一种多元质子酸——一个柠檬酸在水中能电离产生多个水合氢离子。柑橘属水果含有的另一种重要成分是抗坏血酸(维生素 C),缺乏维生素C会导致坏血病。 /©Obodai26
酸和碱的概念可能是最熟悉的化学概念之一。很多食物与酸碱性有关,醋是常用的调味品,其风味主要源于乙酸。而在和面的过程中加入少量碱,可以增强面条的黏性、弹性,改变口感。日常生活中也经常接触酸碱的概念,例如空气污染可以导致酸雨,旱地的土地盐碱化。对于化学家来说,酸碱概念是化学中最重要的概念之一,因为许多化学反应可以表示为某种形式的酸碱反应,应用酸碱概念的可以解决很多化学问题。
本章和下一章有很多内容与前几章相关,包括元素周期律(第9章)、分子结构和形状(第10章)、化学键(第11、12章)、热力学(第7、13章)以及化学平衡(第15章)。我们需要结合之前学过的概念,来理解酸、碱及酸碱反应的本质。学习完本章,你将能回答一些重要的问题,如为什么有些酸是强酸,有些酸是弱酸;为什么有些酸碱反应是完全的,有些只能部分进行?本章的最后以酸(碱)性与物质结构的关系作为结束,这一节我们将了解分子结构对其性质的重要影响。这节学习的一些概念将在第26和27章——有机化学部分再次认识,并将伴随此后《有机化学》课程的全部内容。
16.1 酸、碱和共轭酸碱对
人们很早就认识到了酸和碱——酸是具有酸味的物质,碱是具有涩味的物质。拉瓦锡时代强酸主要是HNO3、H2SO4等含氧酸,因此他在1776年错误地提出氧是酸中共同的元素,并将氧气命名为oxygène(形成酸的)。直到1810年戴维发现H2S和卤化氢也是酸,但不含氧原子——氢才是酸中共同的元素。
阿伦尼乌斯在以其电离研究的一部分为基础,在1884年提出了新的酸碱理论。阿伦尼乌斯酸碱理论中,酸在水溶液中解离出氢离子,而碱则解离出氢氧根离子。阿伦尼乌斯理论只关注溶质,而忽略了溶剂分子的关键作用,因此被更加现代的理论所代替。
布仑斯惕-劳里理论(Brønsted–Lowry theory)是最常用的酸碱理论之一,广泛用于水溶液中的反应。1923年丹麦化学家约翰内斯·尼古劳斯·布仑斯惕和英国化学家托马斯·马丁·劳里分别提出酸是质子给体(proton donor),而碱是质子受体(proton acceptor)。考虑乙酸在水中的电离:
在反应中,乙酸作为质子给体(酸)提供一个质子,变为乙酸根,而水作为质子受体(碱)获得一个质子,变成水合氢离子(hydronium ion)。该反应的逆反应是水合氢离子作为酸,而乙酸根作为碱。我们把相差一个质子(H+)的物种称为共轭酸碱对(conjugate acid–base pair),乙酸和乙酸根是共轭酸碱对,而水和水合氢离子也是共轭酸碱对。
注意CH3COOH分子中—COOH基团的H原子是可电离的(酸性的),而—CH3的H是不可电离的。16.8节将会介绍什么样的氢原子才可电离,现在我们只需知道酸包含可电离H原子。
考虑另一个反应,NH3在水中的电离:
这两个反应都是可逆反应,我们会在16.3学习酸或碱电离的程度。在本节结尾我们总结一下布仑斯惕-劳里理论的一些要点:
- 酸至少包含一个可电离的H原子,而碱包含具有孤对电子的原子,质子可以结合到该原子上。根据可电离H原子的数量,我们用HA(一元酸),H2A(二元酸)和H3A(三元酸)等表示酸。而碱用:B表示,这个式子强调了碱具有孤对电子。某些物质同时具有可电离的氢原子和孤对电子,我们称之为两性的。例如水在醋酸电离反应中作酸,而在氨电离反应中作碱,水是两性的。
- 共轭酸碱对的酸和碱化学式相差一个质子(H+),多了一个H+的是酸,另一个是碱。例如H3O+和H2O中H2O是共轭碱;而H2O和OH−中H2O是共轭酸。同样的,NH4+和NH3中NH3是共轭碱,而NH3和NH2−中NH3是共轭酸。
- 酸加入水中使水质子化为水合氢离子(H3O+),碱加入水中使水去质子化形成氢氧根(OH−)。布仑斯惕-劳里理论考虑了溶剂在其中的作用,因此比阿伦尼乌斯理论更加有用。
在做例题之前,我们了解一下水合氢离子的性质。如第五章说提到的,水合氢离子并不如化学式H3O+这么简单,H3O+可以和多个水分子形成氢键,组成更复杂的离子。氢离子周围没有电子——我们也将其称为质子,质子(原子核)的半径相比于原子小得多。因此质子在反应中不能单独存在,其必须和某些电子结合,例如孤对电子。在某些极端的情况下,例如质子和甲烷在非水溶剂中可以结合得到CH5+离子,这一离子以特殊的方式成键。
例题
对于以下反应,判断正反应和逆反应中酸和碱是什么物质:
HClO2 + H2O ⇌ ClO2− + H3O+ OCl− + H2O ⇌ HOCl + OH− NH3 + H2PO4− ⇌ NH4+ + HPO42− HCl + H2PO4− ⇌ Cl− + H3PO4 解答
寻找反应中的共轭酸碱对——共轭酸作酸失去质子得到共轭碱,而共轭碱获得质子变为共轭酸。第一个反应的两个共轭酸碱对为HClO2-ClO2−以及H3O+-H2O,因此HClO2和H3O+是酸,而ClO2−和H2O是碱。
HCl酸O2 + H2碱O ⇌ Cl碱O2− + H3酸O+ OC碱l− + H2酸O ⇌ HO酸Cl + OH碱− NH碱3 + H2P酸O4− ⇌ NH酸4+ + HP碱O42− HC酸l + H2P碱O4− ⇌ Cl碱− + H3P酸O4 练习
HNO2,PO43−,HCO3−,这三个物种有一个是酸,有一个是碱,有一个是两性的。写出与此相关的四个方程式。
16.2 水的自偶电离和pH值
水分子是两性分子——既可以作为酸,也可以作为碱。我们毫不惊讶水分子之间可以通过自偶电离产生H3O+离子和OH−离子:
这一反应中,有一个水分子作酸,另一个水分子作碱。这一反应平衡倾向于左边,因此平衡时纯水中只含有极少量的离子,但可以通过测量电导率来证明存在这些离子。反应的平衡常数在0 °C下约为1.14×10−14,而100 °C下约为5.45×10−13。该反应的热力学平衡常数$K_\text{w}$称为水的离子积(ion produc of water),$K_\text{w}$ = [H3O+][OH−]。这个表达式省略了$(1/c^\ominus)^{\Delta\nu}$,因为理想溶液中,浓度以mol/L为单位时,$K_\text{w}$和$K_\text{c}$数值上相等。
我们更加关心水在25 °C时的$K_\text{w}$,其值为1.0×10−14,因此25 °C的纯水,[H3O+] = [OH−] = 1.0×10−7 M。$K_\text{w}$的表达式也可用于水溶液,因此有:
往水中加入酸增加[H3O+],必定会降低[OH−]使得两者乘积不变;相反要降低[H3O+]则需要增加[OH−]。
水的自偶电离是一个很重要的反应,因为其揭示了水溶液中[H3O+]和[OH−]的关系。但在处理实际问题时,我们极少考虑该反应——除非是极稀的溶液。往水中加入酸或者碱都会抑制水的自偶电离:
根据勒夏特列原理,往水中加入酸或者碱都会导致右边的物种浓度增加,反应向左移动,部分抑制水的电离。因此在25 °C的水溶液中,水的自偶电离对[H3O+]和[OH−]的贡献都小于1.0×10−7 M。显然该贡献只有在极稀的溶液中才需考虑。
pH和pOH值
1909年丹麦生物学家瑟伦·索伦森(Søren Sørensen, 1868-1939)提出用pH来代指『氢离子的电势』。他定义pH为[H+]的负对数:
例如[H3O+] = 2.5×10−4 M的溶液,其pH = −lg(2.5×10−4) = 3.60
类似,知道溶液的pH也可以计算出其[H3O+],pH为4.50的溶液,[H3O+] = 10−4.50 = 3.2×10−5 M。
同样的,pOH定义为[OH−]的负对数:
还有个有用的表达式是$\text{p}K_\text{w}$,其为$K_\text{w}$的负对数:$\text{p}K_\text{w}=-\lg K_\text{w}$。易知$\text{p}K_\text{w}$ = pH + pOH。因为25 °C下水的$K_\text{w}$ = 1.0×10−14,因此有:
酸性、碱性和中性溶液
纯水中[H3O+]和[OH−]相等,而往水中加入酸或碱后,两者不再相等。通过比较[H3O+]和[OH−]的值,可将溶液分为酸性、碱性和中性的。[H3O+]、[OH−]、pH和pOH的总结在下表中。
| 关系 | 中性溶液 | 酸性溶液 | 碱性溶液 |
|---|---|---|---|
| [H3O+]和[OH−] | [H3O+] = [OH−] | [H3O+] > [OH−] | [H3O+] < [OH−] |
| 25 °C下的[H3O+] | = 1.0×10−7 M | > 1.0×10−7 M | < 1.0×10−7 M |
| 25 °C下的[OH−] | = 1.0×10−7 M | < 1.0×10−7 M | > 1.0×10−7 M |
| 25 °C下的pH | = 7 | < 7 | > 7 |
| 25 °C下的pOH | = 7 | > 7 | < 7 |
生活中很多常见物质的pH如下,有一些是酸性的,有一些是碱性的。我们可以通过pH计(第19.4节)或者酸碱指示剂(第17.3节)判断pH。
例题
在25 °C下测量雨水以及氨水的pH,雨水的pH是4.35,而氨水的pH是11.28。计算雨水的[H+]和氨水的[OH−]。
解答
雨水中[H+] = 10−4.35 = 4.5×10−5 M。
而氨水的pOH = 14 − pH = 2.72,因此[OH−] = 10−2.72 = 1.9×10−3 M
练习
一个酸奶样品在25 °C下的pH是2.85,酸奶中的[H+]和[OH−]是多少?
16.3 酸和碱的电离
此前我们了解过利用电导率区分强电解质和弱电解质:氯化氢是强电解质,而乙酸是弱电解质。氯化氢和乙酸在水中都会发生电离,产生氢离子。若用pH计测量0.063 M盐酸溶液,其pH为1.20;而测量0.10 M乙酸溶液,其pH为2.80。上述数据说明HCl能电离出更多的[H3O+],即使HCl的浓度低于CH3COOH。因此HCl的电离程度大于CH3COOH,HCl是比CH3COOH强得多的酸。通过实验可以确定一系列酸或碱的强度。
| 酸(从上至下变弱) | 共轭碱(从上至下变强) | ||
|---|---|---|---|
| 高氯酸 | HClO4 | 高氯酸根 | ClO4− |
| 氢碘酸 | HI | 碘离子 | I− |
| 氢溴酸 | HBr | 溴离子 | Br− |
| 氢氯酸 | HCl | 氯离子 | Cl− |
| 硫酸 | H2SO4 | 硫酸氢根 | HSO4− |
| 硝酸 | HNO3 | 硝酸根 | NO3− |
| 水合氢离子 | H3O+ | 水 | H2O |
| 硫酸氢根 | HSO4− | 硫酸根 | SO42− |
| 亚硝酸 | HNO2 | 亚硝酸根 | NO2− |
| 乙酸 | CH3COOH | 乙酸根 | CH3COO− |
| 碳酸 | H2CO3 | 碳酸氢根 | HCO3− |
| 铵离子 | NH4+ | 氨 | NH3 |
| 碳酸氢根 | HCO3− | 碳酸根 | CO32− |
| 水 | H2O | 氢氧根 | OH− |
| 甲醇 | CH3OH | 甲氧基负离子 | CH3O− |
| 氨 | NH3 | 氨基负离子 | NH2− |
酸或碱的强度可以通过平衡常数定量描述,一元布仑斯惕-劳里酸可以用HA表示,因此电离反应可以写成:
该反应的热力学平衡常数$K$定义为:
同样的,理想溶液中浓度用mol/L表示时,我们可以省略掉$(1/c^\ominus)^{\Delta\nu}$,得到数值上等于$K$的$K_\text{a}$,称为酸电离常数(acid ionization constant)。
$K_\text{a}$的值因酸而异,有天壤之别。HI的$K_\text{a}$约为109,而CH3CH3的$K_\text{a}$约为10−40。我们通常使用$\text{p}K_\text{a}$表示酸的强度,$\text{p}K_\text{a}$被定义为:
因此HI的$\text{p}K_\text{a}$为−9,而CH3CH3的$\text{p}K_\text{a}$为40。
类似的,定义碱电离常数(base ionization constant, $K_\text{b}$),以及$\text{p}K_\text{b}$:
| 氢卤酸强酸 | 含氧酸强酸 | 碱金属的强碱 | 碱土金属的强碱 |
|---|---|---|---|
| HCl | HClO4 | LiOH | Mg(OH)2 |
| HBr | HNO3 | NaOH | Ca(OH)2 |
| HI | H2SO4 | KOH | Sr(OH)2 |
| RbOH | Ba(OH)2 | ||
| CsOH |
$K_\text{a}$和$K_\text{b}$表示酸或碱的强度,请记住如下几点:
- 强酸或强碱的$K_\text{a}$和$K_\text{b}$远大于1:因此强酸和强碱的电离几乎完全进行。多数情况下将其视为完全电离是合理的,但非常浓的溶液中可能存在大量未电离的分子,例如浓盐酸中存在HCl分子。常见的强酸或强碱相对较少,我们一般不会说强酸强碱的$K_\text{a}$和$K_\text{b}$值,因为其足够大,在通常情况下强酸强碱是几乎完全电离的。上表列出的强酸是分子化合物,而强碱是可溶性离子化合物。分子化合物在水中电离产生水合氢离子及相应的A−离子;而离子型氢氧化物固体以阳离子和氢氧根存在,溶于水后解离成自由离子。
- 弱酸和弱碱的$K_\text{a}$和$K_\text{b}$远小于1,因此弱酸和弱碱的电离是有限的,大部分酸或碱都未电离。要获得平衡时溶液的组成,需要用化学平衡知识进行计算。部分弱酸和弱碱的$K_\text{a}$和$K_\text{b}$在下表中给出。
| 弱酸 | 化学式 | 共轭碱 | $K_\text{a}$ | $\text{p}K_\text{a}$ |
|---|---|---|---|---|
| 碘酸 | HIO3 | IO3− | 1.6×10−1 | 0.80 |
| 亚氯酸 | HClO2 | ClO2− | 1.1×10−2 | 1.96 |
| 氯乙酸 | ClCH2COOH | ClCH2COO− | 1.4×10−3 | 2.85 |
| 亚硝酸 | HNO2 | NO2− | 7.2×10−4 | 3.14 |
| 氢氟酸 | HF | F− | 6.6×10−4 | 3.18 |
| 甲酸 | HCOOH | HCOO− | 1.8×10−4 | 3.74 |
| 苯甲酸 | C6H5COOH | C6H5COO− | 6.3×10−5 | 4.20 |
| 叠氮酸 | HN3 | N3− | 1.9×10−5 | 4.72 |
| 乙酸 | CH3COOH | CH3COO− | 1.8×10−5 | 4.74 |
| 次氯酸 | HClO | ClO− | 2.9×10−8 | 7.54 |
| 氢氰酸 | HCN | CN− | 6.2×10−10 | 9.21 |
| 苯酚 | C6H5OH | C6H5O− | 1.0×10−10 | 10.00 |
| 过氧化氢 | H2O2 | HO2− | 1.8×10−12 | 11.74 |
上表中很多酸包含羧基—COOH,这是一个官能团,其为许多有机酸的共同特征,含有羧基的有机酸也叫羧酸。羧酸与碱反应将会失去羧基的H。很多生物分子包含羧基,如乳酸、所有的氨基酸。
| 弱碱 | 化学式 | 共轭酸 | $K_\text{b}$ | $\text{p}K_\text{b}$ |
|---|---|---|---|---|
| 二乙胺 | (CH3CH2)2NH | (CH3CH2)2NH2+ | 6.9×10−4 | 3.16 |
| 乙胺 | CH3CH2NH2 | CH3CH2NH3+ | 4.3×10−4 | 3.37 |
| 氨 | NH3 | NH4+ | 1.8×10−5 | 4.74 |
| 羟胺 | HONH2 | HONH3+ | 9.1×10−9 | 8.04 |
| 吡啶 | C5H5N | C5H5NH+ | 1.5×10−9 | 8.82 |
| 苯胺 | C6H5NH2 | C6H5NH3+ | 7.4×10−10 | 9.13 |
上表中的弱碱都包含氮原子,并非所有的弱碱都含N原子,但大多数弱碱含有N原子。表中的弱碱与布仑斯惕-劳里酸反应后,N被质子化。此外表格中的化合物除了吡啶外都是胺类,其可以看成是氨NH3的H被一些基团(—C6H5, —CH2CH3, —OH或—CH3)取代所得到的。
酸和碱在水中的电离程度用电离度(degree of ionization, $\alpha$)或电离百分数(percent ionization)来描述,对于酸HA的电离,电离度定义为:$\alpha=[\text{A}^-]/c_\text{i,HA}$,其中[A−]是由HA电离出的A−的浓度,而$c_\text{i,HA}$是HA的起始浓度。同样的,对于碱B电离度$\alpha=[\text{HB}^+]/c_\text{i,B}$。
显然电离度等于以电离形式存在的酸或碱的分数。$\alpha$的取值范围应当是[0,1],$\alpha=0$意味着该物质不电离,而$\alpha=1$意味着完全电离。从热力学角度上看,没有反应是完全不发生或完全进行的,因此$\alpha$一般介于0和1之间。我们把$\alpha$乘以100%得到电离百分数。
通常酸或碱的电离度由两个因素决定:电离常数$K$和浓度$c$。我们固定初始浓度为1.0 M,用电离度对电离常数作图:
 浓度为1.0 M的溶液电离度随电离常数的关系
浓度为1.0 M的溶液电离度随电离常数的关系 浓度为1.0 M的溶液电离度随电离常数的关系
浓度为1.0 M的溶液电离度随电离常数的关系
上图可以看出,$K$越大电离越完全。硝酸的$K_\text{a}=20$,1.0 M硝酸的电离度$\alpha=0.95$,因此硝酸被认为是一种强酸。
例题
计算1.00 M HA(aq)的电离度,假定$K_\text{a}$是(a) 1.00×105 (b) 1.00×10−5
解答
对于(a),$K_\text{a}\gg 1$,电离是基本完全的。写出ICE表:
$$ \matrix{ &\text{HA}&\rightleftharpoons&\text{H}^+&+&\text{A}^-\\ \text{completion}&0&&1.00&&1.00\\ \text{change}&x&&-x&&-x\\ \text{end}&x&&1.00-x&&1.00-x }$$ 解方程,$\frac{(1-x)^2}{x}=10^5$,解得$x\approx10^{-5}$。因此电离度为99.999%。对于(b),$K_\text{a}\ll 1$,电离基本不发生。同样写出ICE表:
$$ \matrix{ &\text{HA}&\rightleftharpoons&\text{H}^+&+&\text{A}^-\\ \text{initial}&1&&0&&0\\ \text{change}&-x&&x&&x\\ \text{end}&1-x&&x&&x }$$ 解方程,$\frac{x^2}{1-x}=10^{-5}$,解得$x$ = 0.00316。因此电离度为0.316%。
练习
硝酸25 °C时的$K_\text{a}$大约为20,计算0.010 M硝酸溶液的电离度。
电离度不仅和$K$有关,也与浓度相关。强酸在通常的浓度下(小于1.0 M)基本完全电离。而弱酸的情况稍有不同,弱酸在稀溶液中的电离度比浓溶液中的更高。例如对于$K_\text{a}$ = 10−5的弱酸,在0.1 M的溶液中电离度大约只有1%;而在10−7 M的溶液中电离度大于99%。
 不同Ka的酸溶液,电离度随浓度的关系
不同Ka的酸溶液,电离度随浓度的关系 不同Ka的酸溶液,电离度随浓度的关系
不同Ka的酸溶液,电离度随浓度的关系
例题
计算1.0 M,0.10 M和0.010 M的乙酸溶液的电离度
解答
乙酸的$K_\text{a}$ = 1.8×10−5,使用ICE表,其中$c_0$是乙酸的初始浓度:
$$ \matrix{ &\text{HA}&\rightleftharpoons&\text{H}^+&+&\text{A}^-\\ \text{initial}&c_0&&0&&0\\ \text{change}&-x&&x&&x\\ \text{end}&c_0-x&&x&&x }$$ 解方程,$\frac{x^2}{c_0-x}$ = 1.8×10−5,代入不同的$c_0$,有$x$ = 4.2×10−3、1.3×10−3、4.2×10−4。因此电离度分别为0.42%、1.3%、4.2%。
练习
肌肉无氧呼吸会产生乳酸,一种羧酸。0.0284 M的乳酸溶液的电离度为6.7%,计算乳酸的$K_\text{a}$。
上述例题表明弱酸或弱碱的电离度随溶液变稀而增加,我们也可以通过勒夏特列原理来理解。稀释溶液相当于降低所有物种的浓度——就好比通过增加容器体积以降低气体反应中所有物种的分压。这一做法会使得反应朝增加可溶物种(气体分子)的方向进行以部分抵消稀释(降低压力)所带来的影响。
该反应正反应朝着增加可溶物种的方向进行,在反应达到平衡后将水溶液体积增加到原来的$V$倍,此时的反应商$Q$由$K_\text{a}$变为$K_\text{a}/V$,因此平衡向右移动,以保持$Q=K_\text{a}$。最终导致电离度增加。
16.4 强酸和强碱
强酸在水中基本完全电离,因此反应使用右箭头 → 而不是 ⇌ :
HCl溶液中的H3O+有两种来源:HCl电离和水的自偶电离。往水中加入HCl会抑制水的自偶电离,因此通常可以忽略,除非HCl浓度非常低。即使是低至1.0×10−6 M HCl(aq),水的自偶电离对H3O+总浓度的贡献也不到1%,更不用说更浓的溶液了。
例题 计算强酸水溶液的离子浓度
计算0.015 M HCl溶液的[H3O+],[Cl−]和[OH−]。
解答
因为HCl的电离是完全的,因此[H3O+] = [Cl−] = 0.015 M。因为[H3O+] [OH−] = 10−14,所以[OH−] = 6.7×10−13 M。
练习
26.5 °C、747 mmHg下的535 mL HCl气体溶于水,获得625 mL溶液。溶液的pH是多少?
氢氧化钙是一种强碱,其在水中完全电离得到Ca2+和OH−。反应方程式如下,注意使用的是右箭头 → 。
得到的溶液称为石灰水,其为强碱性的。这一反应是溶液中OH−的主要来源,因为此时水的自偶电离可以忽略不计。
例题 计算强碱水溶液的pH
氢氧化钙又叫熟石灰,是一种廉价的强碱,主要用于不需要高浓度OH−的场合。Ca(OH)2(s)微溶于水,25 °C下溶解度为0.16 g Ca(OH)2(s)/100 mL溶液。计算25 °C下Ca(OH)2饱和溶液的pH。
解答
根据溶解度计算得知Ca(OH)2饱和溶液的浓度为0.022 M,因此[OH−] = 0.044 M,pOH = 1.36,因此pH = 12.64。
练习
氢氧化镁的溶解度为9.63 mg Mg(OH)2(s)/100 mL,计算饱和氢氧化镁溶液的pH。
16.5 弱酸和弱碱
为了计算弱酸或弱碱在水中的pH,我们需要进行平衡计算,这是一个有挑战性的难点。因为溶液中涉及的物种可能非常的多,有时候无从下手。我们要首先理清思路,确定几个问题:
- 溶液中的主要物种是什么?
- 发生了哪些化学反应?
- 能否忽略某些反应?(如水的自偶电离)
- 能否作出假设以简化计算?
- 合理的答案是什么?例如溶液应该呈酸性还是碱性。
在动笔前,应当先整理好思路,再用清晰合理的方法抽丝剥茧,逐渐将问题简化为熟悉的内容。这里有三个例题,后两个例题是让你计算溶液的pH值,通常会涉及一元二次方程求解。利用计算器的解方程功能,可以快速、简便地求出正确结果。
例题 已知弱酸溶液的pH,计算$K_\text{a}$
丁酸CH3(CH2)2COOH可用于制造人造调味剂和糖浆。0.250 M的丁酸水溶液的pH值为2.72。计算丁酸的$K_\text{a}$。
CH3(CH2)2COOH(aq) + H2O(l) ⇌ CH3(CH2)2COO−(aq) + H3O+(aq) 解答
pH = 2.72表明溶液中[H3O+] = 1.9×10−3 M,写出ICE表:
$$ \matrix{ &\text{HA}&\rightleftharpoons&\text{H}^+&+&\text{A}^-\\ \text{i}&0.25&&0&&0\\ \text{c}&-1.9×10^{−3}&&1.9×10^{−3}&&1.9×10^{−3}\\ \text{e}&0.248&&1.9×10^{−3}&&1.9×10^{−3} }$$ 因此反应的$K_\text{a}$ = 1.5×10−5
练习
可卡因(C12H21O4N)是一种生物碱,因成瘾性而被严格管制。可卡因在水中的溶解度为0.17 g / 100 mL,饱和溶液的pH = 10.08。计算可卡因的$K_\text{b}$。
例题 计算弱酸溶液的pH
计算0.100 M乙酸的pH,其是否符合16.3节提到的测量结果pH ≈ 2.80?乙酸的$K_\text{a}$ = 1.8×10−5
解答
计算可知[H3O+] = 1.3×10−3 M,因此pH = 2.89,符合。
练习
乙酰水杨酸C6H4(OOCCH3)COOH是药物阿斯匹林的活性成分,是一种羧酸。其$K_\text{a}$ = 3.3×10−4,计算500 mg乙酰水杨酸溶于325 mL水所得溶液的pH。
例题 计算弱碱溶液的pH
计算0.00250 M甲胺CH3NH2溶液的pH,甲胺的$K_\text{b}$ = 4.2×10−4。
解答
使用ICE表:
$$ \matrix{ &\text{B·H}_2\text{O}&\rightleftharpoons&\text{OH}^-&+&\text{HB}^+\\ \text{I}&0.0025&&0&&0\\ \text{C}&-x&&x&&x\\ \text{E}&0.0025-x&&x&&x }$$ 有$\frac{x^2}{0.0025-x}$ = 4.2×10−4,解得$x$ = 1.0×10−3,因此pOH = 3.08,pH = 10.92。
练习
黑莓中含有少量的哌啶(C5H10N),哌啶的$K_\text{b}$ = 1.6×10−3。计算114 mg哌啶溶于315 mL水所得溶液的pH。
简化计算的假设
我们可以假设弱酸或弱碱基本没有电离,因此$[\text{HA}]=c_\text{HA}$。通常来说,这一假设在弱酸$c_\text{A}$或弱碱$c_\text{B}$的浓度超过$K_\text{a}$或$K_\text{b}$100倍以上时成立。此时我们可以得到一个非常简单的表达式:[H3O+] = $\sqrt{K_\text{a} c_\text{HA}}$或[OH−] = $\sqrt{K_\text{b} c_\text{B}}$。
做出任何假设后都不要忘记证明假设是合理的。如果假设带来的误差在5%内,则其通常没问题。读者可以自行计算在此前的两个例题中应用该假设会带来多少误差。
16.6 多元酸
此前在表16-4中列出的都是一元酸,因此分子中有且仅有一个可电离的H原子。某些分子可以包含多个可电离的氢原子,其为多元酸(polyprotic acids)。
| 酸 | 共轭 | 共轭碱 | 电离常数$K_\text{a}$ | $\text{p}K_\text{a}$ |
|---|---|---|---|---|
| 氢硫酸a | H2S | HS− | 1.0×10−7 | 7.00 |
| HS− | S2− | 1×10−19 | 19.0 | |
| 碳酸b | H2CO3 | HCO3− | 4.4×10−7 | 6.36 |
| HCO3− | CO32− | 4.7×10−11 | 10.33 | |
| 柠檬酸 | H3C6H5O7 | H2C6H5O7− | 7.5×10−4 | 3.12 |
| H2C6H5O7− | HC6H5O72− | 1.7×10−5 | 4.77 | |
| HC6H5O72− | C6H5O73− | 4.0×10−7 | 6.40 | |
| 磷酸 | H3PO4 | H2PO4− | 7.1×10−3 | 2.15 |
| H2PO4− | HPO42− | 6.3×10−8 | 7.20 | |
| HPO42− | PO43− | 4.2×10−13 | 12.38 | |
| 草酸 | H2C2O4 | HC2O4− | 5.6×10−2 | 1.25 |
| HC2O4− | C2O42− | 5.4×10−5 | 4.27 | |
| 亚硫酸c | H2SO3 | HSO3− | 1.3×10−2 | 1.89 |
| HSO3− | SO32− | 6.2×10−8 | 7.21 | |
| 硫酸d | H2SO4 | HSO4− | 很大 | <0 |
| HSO4− | SO42− | 1.1×10−2 | 1.96 |
a 氢硫酸的$K_\text{a2}$在旧文献中为1×10−14,新的实验证据表明过去我们高估了$K_\text{a2}$
b [H2CO3]在水溶液中含量很低,所给的$K_\text{a1}$实际源于反应:CO2(aq) + 2 H2O ⇌ H3O+ + HCO3−
c 不存在H2SO3这个物质,所给的$K_\text{a1}$实际源于反应:SO2(aq) + 2 H2O ⇌ H3O+ + HSO3−
d H2SO4的第一步电离是完全的
上表列出了一些多元酸及其电离常数,我们重点考虑磷酸。H3PO4有三个可以电离的H原子,因此磷酸是三元酸。其电离分为三个步骤:
我们应当注意到:
- $K_{\text{a}1}$远大于$K_{\text{a}2}$或$K_{\text{a}3}$,因此绝大多数[H3O+]都来源于第一级电离。
- 第一级电离产生的H2PO4−很少进一步电离,因此可以假设[H2PO4−] = [H3O+]
- [HPO42−] ≈ $K_{\text{a}2}$,与磷酸的浓度无关(思考这个公式是怎么得到的)。
例题 计算多元酸溶液的离子浓度
计算3.0 M磷酸溶液中的:[H3O+],[H2PO4−],[HPO42−]和[PO43−]。
解答
因为绝大多数[H3O+]源于第一级电离,使用ICE表:
$$ \matrix{ &\text{H}_3\text{PO}_4&\rightleftharpoons&\text{H}_2\text{PO}^-_4&+&\text{H}^+\\ \text{E}&3-x&&x&&x }$$ 解得$x$ = 0.14,因此[H3O+] = 0.14 M。一级电离产生的H2PO4−很少进一步电离,因此[H2PO4−] = 0.14 M。
然后考虑二级电离,写出部分的ice表:
$$ \matrix{ &\text{H}_2\text{PO}^-_4&\rightleftharpoons&\text{H}\text{PO}^{2-}_4&+&\text{H}^+\\ \text{E}&0.14-y&&y&&0.14+y }$$ 因为$y$是一个很小的值0.14 − y和0.14 + y可近似看成0.14,因此y = $K_\text{a2}$ = 6.3×10−8,故[HPO42−] = 6.3×10−8 M。现在来计算[PO43−]的浓度,考虑三级电离,写出部分的ice表:
$$ \matrix{ &\text{H}\text{PO}^{2-}_4&\rightleftharpoons&\text{PO}^{3-}_4&+&\text{H}^+\\ \text{E}&6.3×10^{-8}&&z&&0.14 }$$ 解得$z$ = 1.9×10−19,[PO43−] = 1.9×10−19 M,这是一个很小的值。
练习
草酸是一种二元羧酸,1.05 M的草酸溶液pH = 0.67,且草酸根的平衡浓度为5.3×10−5 M。计算草酸的$K_\text{a1}$和$K_\text{a2}$。
要得到陈述(2)和陈述(3)的结论,看起来陈述(1)是必不可少的。但实际上只要多元酸的第一级电离是弱的(不完全的),即使$K_{\text{a}1}$和$K_{\text{a}2}$区别不大,[H3O+]也主要由第一级电离产生。因为弱的电离所产生的负一价阴离子浓度远小于酸的浓度,二级电离产生的[H3O+]可忽略不计。
例外:H2SO4
硫酸不适用于上述陈述,因为硫酸的一级电离是完全的,硫酸是强酸。而硫酸的二级电离不完全,即硫酸氢根是一个弱酸。因此较低浓度的硫酸溶液中[H2SO4] ≈ 0。例如0.50 M的H2SO4溶液,可以将其看成0.50 M的H3O+和0.50 M HSO4−。
例题 计算硫酸溶液的离子浓度
计算0.50 M硫酸溶液中的:[H3O+],[HSO4−]和[SO42−]。
解答
硫酸的一级电离完全,因此可看成0.50 M H3O+和0.50 M HSO4−的混合溶液。使用ICE表:
$$ \matrix{ &\text{HSO}_4^-&\rightleftharpoons&\text{H}^+&+&\text{SO}^{2-}_4\\ \text{I}&0.5&&0.5&&0\\ \text{C}&-x&&x&&x\\ \text{E}&0.5-x&&0.5+x&&x }$$ 解方程:$\frac{(0.5+x)x}{0.5-x}$ = 1.1×10−2,因此$x$ = 0.011。所以[H3O+] = 0.51 M,[HSO4−] = 0.49 M,[SO42−] = 0.011 M。
练习
计算0.020 M硫酸溶液的[H3O+],[HSO4−]和[SO42−]。
16.7 酸碱反应的通用方法
到目前为止,我们在解决问题时使用了各种简化假设,例如忽略水的自偶电离、忽略多元酸的多级电离。如果不做出任何简化,如何进行计算?我们可以依照三个步骤进行:
- 确定溶液中的物种(不包括H2O),写出涉及这些物种的反应方程式,将这些物种的浓度视为未知数。
- 写出涉及这些物种浓度的方程式,包括三类:平衡常数、物料守恒、电荷守恒。
- 求解含有未知数的方程。
以0.10 M H3PO4为例,H3PO4是三元酸,电离产生[H2PO4−],[HPO42−],[PO43−],当然还有[H3O+]。此外由于水的自偶电离,溶液中也存在[HO−]。
因此溶液中存在的物种有: [H3PO4],[H2PO4−],[HPO42−],[PO43−],[H3O+],[HO−]
涉及的反应包括:
现在有六个未知数,但只有四个方程,还不能求解。我们还需两个独立的方程,来自物料守恒和电荷守恒。物料守恒是指含磷物种的总浓度等于H3PO4的初始浓度:
而电荷守恒方程中正离子电荷和等于负离子电荷和,注意携带多个电荷的离子需要乘以相应的系数:
现在我们有四个平衡方程、一个物料守恒、一个电荷守恒,通过计算机可以求解所有物种的浓度。这一方法不带任何近似,得到的结果是最为精确的。
16.8 离子的水解
此前我们提到的酸或者碱多数是电中性物质,如HCl、CH3COOH和NH3、CH3NH2。但我们也看到H2PO4−离子可以作为酸,电离产生H3O+。
考虑如下两种盐在水中的反应:
在第一个反应中,NH4+是一种酸,其提供质子给水,水在反应中作碱。该反应的平衡常数通过铵离子的酸电离常数$K_\text{a}$描述:
我们改写上述方程式,上下同时乘以[OH−],乘积[H3O+][HO−]是水的离子积$K_\text{w}$,而剩余部分是NH3的$K_\text{b}$的倒数。因此NH4+的$K_\text{a}$ = 5.6×10−10。
酸与其共轭碱的电离常数的乘积等于水的离子积:
在第二个反应中,CH3COO−从水中获得质子而作碱,我们可以计算CH3COO−的$K_\text{b}$:$K_\text{b}=K\text{w}/K_\text{a}$ = 5.6×10−10。
可以发现,酸越强,其共轭碱越弱;酸越弱,其共轭碱越强。这并不意味着弱酸的共轭碱是强碱。比较乙酸的$K_\text{a}$和乙酸根的$K_\text{b}$,我们发现:
弱酸(碱)的共轭碱(酸)也是弱的。
现在我们来计算强酸的共轭碱的$K_\text{b}$。强酸的$K_\text{a}$非常大,$K_\text{a}\gg 1$,因此$K_\text{b}$将远小于$K_\text{w}$。例如HI的$K_\text{c}$大约为109,因此I−的$K_\text{b}$大约为10−23。
强酸(碱)的共轭碱(酸)是极弱的。
水解
在25 °C的纯水中,[H3O+] = [HO−] = 1.0×10−7 M,pH = pOH = 7.00,纯水的pH是中性的。而NaCl溶于水后,其完全解离为Na+和Cl−,溶液的pH还是7.00,因为Na+和Cl−均不与水反应。
Cl−不与水反应并不足为奇,因为Cl−是强酸HCl的共轭碱,所以Cl−是极弱碱,在水中几乎不质子化,因此不影响溶液的pH值。第16.11节会解释为何Na+也不影响溶液的pH。
而往水中加入NH4Cl后,水的pH降低。这表明水中的[H3O+] > [HO−],说明有反应能产生[H3O+]:
NH4+和H2O的反应和酸的电离没有本质区别,但我们通常将离子和水的反应称为水解反应。铵离子可以发生水解。
而乙酸钠溶解在水中会导致水的pH增加,这表明水中的[HO−] > [H3O+],因此乙酸根发生了水解:
盐溶液的pH
我们可以对盐溶液的pH进行定性预测和定量计算,只有反应产生弱酸或弱碱的盐才能水解。总的来说:
- 带+1或+2电荷的金属离子通常不影响溶液的pH。而带有较高电荷的离子(如Al3+,Fe3+,Cr3+等)可能影响溶液的pH。我们知道溶液中的离子是水合的,如果金属离子带的正电荷很大,那么离金属最近的水分子会倾向于向外提供质子,从而增加溶液的[H3O+]。
- 一些多原子阳离子在水中作酸。例如NH4+以及质子化的胺。和NH3一样,胺是弱碱,因此NH4+和RNH3+是弱酸。
- 许多阴离子在水中作碱。考虑负离子A−的性质时,不妨考虑其共轭酸HA的酸性。若HA是弱酸,A−是弱碱,其会水解并影响溶液的pH。若HA是强酸,A−是极弱碱,不会与水反应产生明显的影响。
处理两性阴离子需格外小心,例如Na2HPO4溶于水得到Na+和HPO42−,Na+不发生反应,但HPO42−有两种可能性:失去一个质子电离产生H3O+和PO43−;从H2O处夺取一个质子,水解得到HO−和H2PO4−。要确定Na2HPO4溶液是酸性还是碱性的,则必须确定HPO42−离子更倾向于作酸还是作碱。我们可以通过比较离子的$K_\text{a}$和$K_\text{b}$。这两个平衡常数可通过H3PO4的电离常数获得:
显然$K_\text{a}$对应于磷酸的三级电离$K_\text{a3}$ = 6.3×10−13,而$K_\text{b}$对应$K_\text{w}$除以HPO42−共轭酸的电离常数,因此$K_\text{b}=K_\text{w}/K_\text{a2}$ = 1.6×10−7。$K_\text{b}>K_\text{a}$,说明水解的趋势大于电离,因此Na2HPO4溶液是碱性的。
例题 定性预测水解反应
以下物质的水溶液是酸性、碱性还是中性的?(a) NaOCl; (b) KCl; (c) NH4NO3
解答
次氯酸是弱酸,因此次氯酸钠溶液是碱性的。KCl溶液为中性,NH4NO3溶液为酸性。
练习
磷酸二氢钠溶液是酸性还是碱性的?
例题 水解反应平衡常数的估计
亚硝酸钠NaNO2和苯甲酸钠NaC6H5COO都用作食品防腐剂。两杯浓度相同的上述盐溶液,何者的pH更高?
解答
查表可知亚硝酸是比苯甲酸更强的酸,因此苯甲酸钠溶液的碱性更强,pH更高。
练习
氰化铵溶液是酸性、碱性还是中性的?
例题 水解反应的pH计算
氰化钠NaCN具有剧毒,但它在金、银提炼和金属电镀中有着非常重要的应用。氰化物应避免酸化,防止释放出有毒的氰化氢气体HCN(g)。NaCN(aq)溶液的pH是什么性的?0.50 M NaCN(aq)的pH是多少?
解答
氰化氢是弱酸,因此氰化钠溶液是碱性的。查表知HCN的$K_\text{a}$ = 6.2×10−10,因此$K_\text{b}$ = 1.6×10−5。写出ICE表,求解方程,计算出[OH−] = 2.8×10−3 M,因此pH为11.45。
练习
氟化钠作为牙膏添加剂具有防龋齿功能。计算0.10 M NaF溶液的pH。
16.9 酸碱反应定性计算
此前我们主要考虑酸或碱与水的反应,我们现在讨论一般情况:酸HA和碱B反应。
这一反应是可逆的,那么反应平衡偏向于反应物HA和B,还是生成物A−和BH+?
如何证明这一想法?我们写出如下的反应方程式及平衡常数:
因此一般情况下酸碱反应的$K=K_{\text{a}}(\text{HA})K_{\text{b}}(\text{b})/K_{\text{w}}$。我们用$K_{\text{a}}(\text{HB}^+)$代替$K_{\text{w}}/K_{\text{b}}(\text{B})$,上式可变为$K=K_{\text{a}}(\text{HA})/K_{\text{a}}(\text{HB}^+)$。另外一种处理方式是用$K_{\text{b}}(\text{A}^-)$代替$K_{\text{w}}/K_{\text{a}}(\text{HA})$,上式变为$K=K_{\text{b}}(\text{B})/K_{\text{b}}(\text{A}^-)$。
假定HA是比BH+更强的酸,那么$K_{\text{a}}(\text{HA})>K_{\text{a}}(\text{HB}^+)$,所以$K>1$,反应平衡偏向于形成BH+,BH+,其为较弱的酸。若BH+是比HA更强的酸,那么$K<1$,反应偏向于形成HA,也为较弱的酸。类似的,平衡倾向于形成较弱的碱。
有没有可能HA是较强的酸,而B是较弱的碱?这不可能,因为B是较弱的碱说明A−是较强的碱,这与HA是较强的酸冲突。我们来用上述规则预测乙酸和吡啶反应的有利方向:
乙酸的$K_\text{a}$和吡啶的$K_\text{b}$可以查表得到,而乙酸根的$K_\text{b}$和吡啶嗡离子的$K_\text{a}$可以由公式计算。显然上述反应平衡偏向于右侧,形成更弱的酸和更弱的碱。
利用平衡常数公式可以得出如下的重要结论,我们将在下章多次使用:
假定HA是一个强酸,那么$K_{\text{a}}(\text{HA})\gg K_{\text{a}}(\text{HB}^+)$,因此$K\gg 1$,说明反应基本完全。类似的,如果B是强碱,那么HA和B的反应也将基本完全,前提是HA的$K_{\text{a}}$大于$K_{\text{w}}$。
16.10 分子结构和酸碱性
我们已经了解了很多关于酸碱平衡计算的知识,但有一些根本问题还没涉及,例如为什么HCl是强酸但HF是弱酸?为什么乙酸的酸性强于乙醇,但弱于氯乙酸?本质上这些问题归于酸之间的强度如何比较,本节我们将了解分子结构和酸碱性的关系。
氢某酸的强度
因为酸失去质子需断键,因此酸的强度似乎和键强有关。一般来说,H—X键越强,酸越弱。强键的特点是键长短,键解离能高。我们应当使用如下公式来描述H—X键的电离:
上述反应在气相中的键解离能可通过如下的热力学循环获得:


因此,$D(\text{H}^+\text{X}^-)=D(\text{H—X})+E_\text{i}(\text{H})+\Delta_\text{ea}H$,其中 $D(\text{H—X})$是反应HX(g) → H(g) + X(g)的键解离能,$E_\text{i}(\text{H})$是氢原子的电离能,$\Delta_\text{ea}H$是X的电子亲合能。$D(\text{H}^+\text{X}^-)$被称为异裂键能。
下图展示了几种元素形成的氢某酸的$D(\text{H}^+\text{X}^-)$。氢某酸的强度随着异裂键能的降低而增加。这一结论符合直觉,将H—X分子分解为H+和 X−的能量越低,酸的强度越大。那我们能否用(均裂)键能$D(\text{H—X})$解释酸的强度?并不能。下图中$D(\text{H—X})$从左到右增加,但酸的强度并没有从左到右降低。因此使用键能预测酸的强度并不正确。
 一些氢某酸的键解离能(kJ mol−1)和$K_\text{a}$
一些氢某酸的键解离能(kJ mol−1)和$K_\text{a}$ 一些氢某酸的键解离能(kJ mol−1)和$K_\text{a}$
一些氢某酸的键解离能(kJ mol−1)和$K_\text{a}$
氢某酸的强度可以通过键长和键的极性来解释。对于相同周期的元素,从左至右随着电负性增加,键的极性增强。极性的H—X键更容易产生H+和X−,因为极性键的电荷是部分分离的。因此周期表从左至右,酸的强度增加:
而对于同族元素,结论会变得不同。从上到下移动时,H—X的键长和酸的强度均会增加,但H—X的极性下降,因此:
HF的酸性相比其他氢卤酸要弱得多,这一现象似乎是反常的。这一情况可以用氢键解释,在HF(aq)中,电离的F−和H3O+通过强氢键结合形成离子对,使得H3O+的浓度没有预期的高。
CH4和NH3基本没有酸性。
含氧酸的酸性
含氧酸的酸性取决于中心原子对O—H键的吸电子能力。有两个因素会使得电子从O—H键上被吸走:(1)中心原子的高电负性;(2)中心原子的末端O原子。
比较HOCl和HOBr的酸性,它们均没有末端氧原子。因此酸性强弱取决于电负性,Cl的电负性大于Br,因此HOCl酸性更强。


而比较H2SO4和H2SO3的酸性,则应当比较中心S原子的末端氧数量。


高电负性的末端O原子可以拉O—H键的电子,削弱键强并增加分子的酸性。H2SO4有两个末端O原子,而H2SO3只有一个O原子,因此H2SO4对O—H的吸电子作用更大,H2SO4是比H2SO3更强的酸。
有机酸的强度
最后我们简要考虑一些有机化合物的酸碱性强弱,这一节内容会在有机化学课程中进一步学习。首先考虑乙醇和乙酸,两个分子都包含一个和碳相连的O—H基团,但乙酸的酸性比乙醇强得多。


这两个化合物酸性巨大差异的第一种解释是因为乙酸包含一个末端氧,其吸走O—H的电子,使得O—H键被削弱,质子更容易电离出来。而更加合适的解释则应当考虑阴离子的结构。


乙酸根存在两个共振结构,每根碳氧键键级为1.5,而每个O原子带0.5个负电荷。简而言之,乙酸根中的负电荷更加分散,这一结果减少了乙酸根的O原子对质子的连接能力,导致乙酸根为弱质子碱。相反,乙氧负离子中负电荷集中在单个O原子上,大大增强了乙氧负离子对亲质子性,因此乙氧负离子是一个比乙酸强得多的碱。共轭碱越强,其相应的酸越弱。
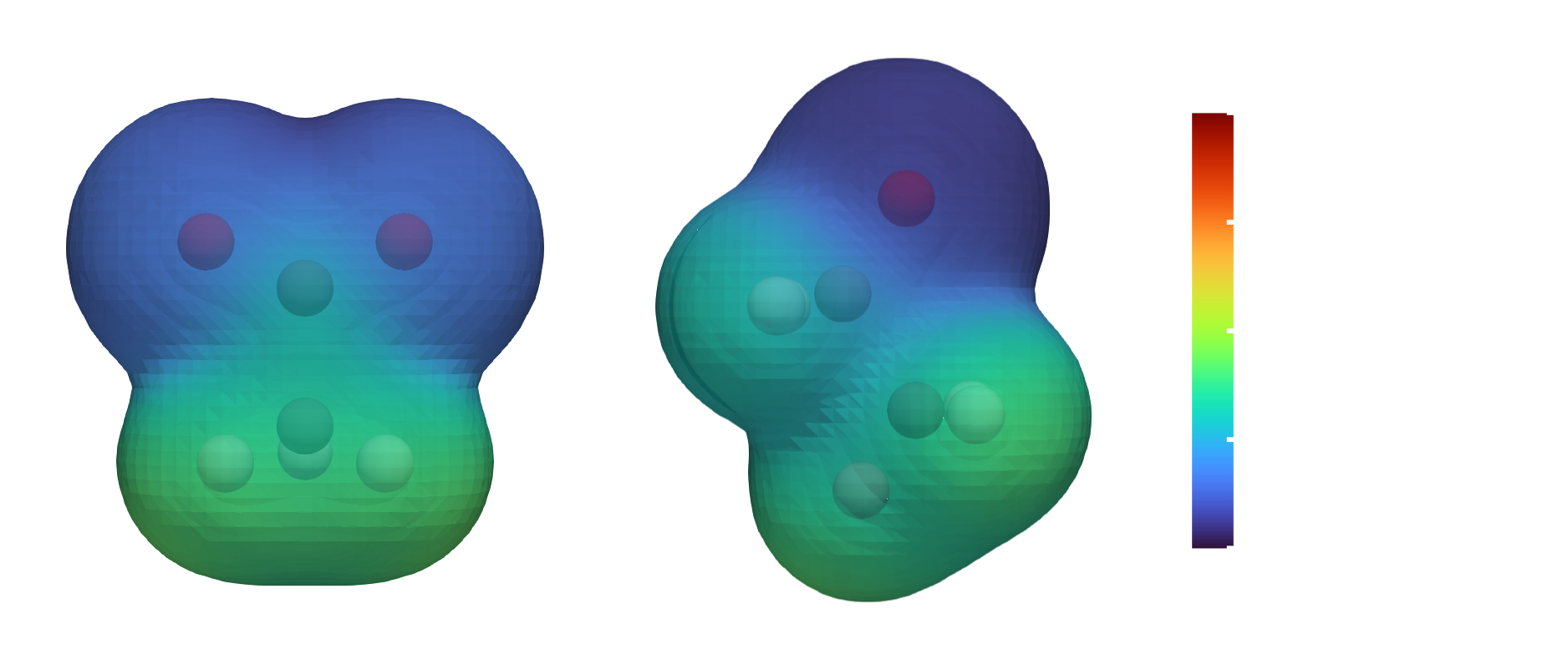 乙酸根和乙氧负离子的静电势图。
乙酸根和乙氧负离子的静电势图。
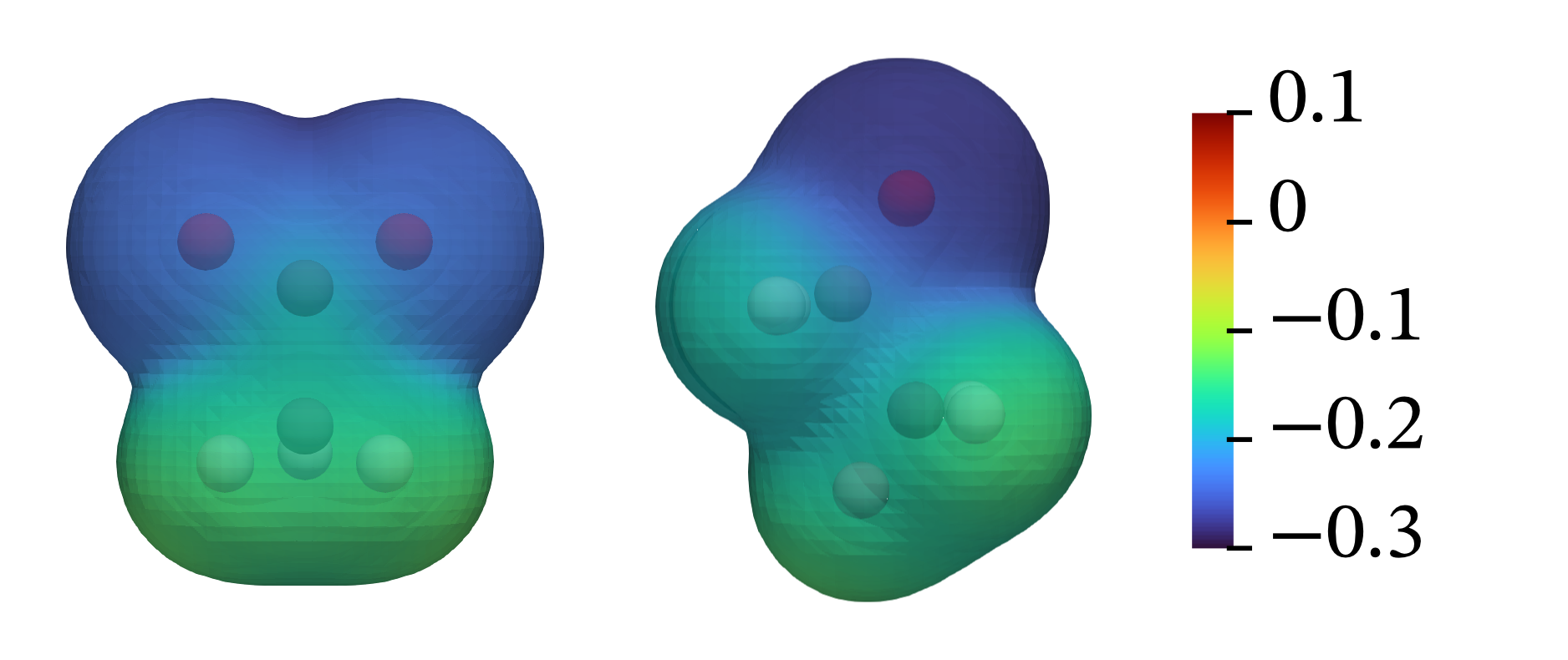 乙酸根和乙氧负离子的静电势图。
乙酸根和乙氧负离子的静电势图。
比较不同的羧酸的强度,乙酸和辛酸(CH3(CH2)6COOH)的强度差不多,说明羧酸中碳链的强度对酸性几乎没有影响。但羧酸碳链上的官能团可能会强烈影响羧基的酸性,例如Cl原子取代了一个乙酸中与C相连的H,得到氯乙酸。高电负性的Cl原子有助于拉走O—H中的电子,使得O—H键减弱,质子更容易失去,成为比乙酸更强的酸。随着官能团与O—H距离的增加,这一效应会迅速减弱。


例题
不查阅数据,比较下面两组化合物的酸性:
(a) H3PO4、HClO3
(a) ClCH2CH2COOH、CH3CHClCOOH
解答
磷酸有一个末端氧,而氯酸有两个,因此氯酸酸性更强。2-氯乙酸相比3-氯乙酸酸性更强,因为氯拉电子,距离羧基越近酸性越强。
练习
不查阅数据,比较三组化合物的酸性:H3PO4、H2SO4;HNO3、HClO4;CCl3CH2COOH、CCl2FCH2COOH。
胺的碱性强度
胺的碱性取决于N的孤对电子与质子结合的能力。电负性比H更大的元素取代NH3的H原子后,电负性基团拉N原子的电子,减少其电子密度。使得孤对电子和质子的结合变弱,即碱性减弱,因此溴胺(NH2Br)是比氨更弱的碱。


烷基没有拉电子能力。当它们连接到胺基上时,CH3和CH3CH2具有给电子能力,因此烷基胺的碱性强于氨。


氨基连在苯环上所得到的胺称为芳香胺,例如苯胺(C6H5NH2)。苯环是一个六碳环,碳原子均提供一个$p$轨道形成离域π键。某些程度上,N的孤对电子也参与了离域,使得孤对电子被分散到苯环上。红色弯曲箭头表示电子对转移方向,下图显示了苯胺的四个共振式,最左边的是主要的,而剩下三个是次要的。


苯环对NH2的拉电子使得苯胺是比环己胺(C6H11NH2)弱得多的碱。另一种解释是苯胺存在多个共振结构,而苯胺质子化后共振结构不复存在。因此相比于苯铵离子,苯胺具有额外的稳定性,减弱了苯胺质子化的趋势。


如果使用高电负性原子取代苯环中的H,将导致NH2基团的电子密度进一步减少,碱性变得更低。此外取代基距离NH2基团越近,效果越显著。下图为对氯苯胺(p-C6H4NH2)和邻氯苯胺(o-C6H4NH2)的$\text{p}K_{\text{b}}$。


酸的强度:总结
16.8节我们了解到酸HA的强度与其共轭碱A−呈负相关,也就是说如果HA具有很强的失质子趋势,那么A−表现出很弱的得质子趋势。也就是说,A−是『稳定的』,因为它不容易被质子化。鉴于HA和A−之间的关系,我们可以从两个角度来考虑酸的强度:
- 导致电子密度远离H原子的因素
- 使A−稳定的因素
对于无机酸,我们主要关注使电子密度远离可电离H的因素,而有机化学家通常关注使A−更稳定——更难质子化的因素。
A−的稳定性取决于很多因素。带负电荷的原子是什么?是否是高电负性原子?原子大小如何?采取什么杂化方式?电荷是离域还是定域的?很多因素共同决定A−的稳定性,不过通常我们只需考虑少数几个因素。概括如下:
- 比较同一周期的原子(大小接近),电负性是主要因素:原子的电负性越强,带负电荷的能力越大。例如CH3O−比NH2−稳定。
- 比较不同周期原子(大小相去甚远),原子半径是主要因素:原子越大,承载负电荷的能力越大。例如HS−比HO−更稳定。
- 阴离子稳定性随着吸电子基团数量的增加而增加,例如ClCH2COO−比CH3COO−更加稳定,但不如Cl3CCOO−稳定。此外吸电子基团距离负电荷越近,阴离子越稳定。例如FCH2COO−比FCH2CH2COO−更稳定。
- 负电荷越分散,阴离子越稳定。某些情况下共振结构的数量并不是唯一因素,共享负电荷的原子的电负性和大小可能作用更为主要。
16.11 路易斯酸碱理论
1923年,路易斯提出了一种与成键及结构密切相关的酸碱理论。路易斯酸碱理论不仅包括涉及H+和OH−的反应,还将酸碱的概念扩展到气相和固相反应中。路易斯酸碱理论对描述有机分子的某些反应时尤为重要。
路易斯酸(Lewis acid)是电子对受体,可以是原子、离子或分子。而路易斯碱(Lewis base)的电子对给体。路易斯酸(A)和路易斯碱(B:)之间的反应导致形成共价键。我们把路易斯酸碱反应的产物称为加合物(adduct)。反应可以表示为:
其中B:A是加合物。通过一个物种向另一个物种提供一对电子而形成的共价化学键的行为称为配位,形成的键称为配位键。路易斯酸是具有可容纳电子对的空轨道的物种;而路易斯碱是具有孤对电子的物种。根据这些定义,OH−不仅是布仑斯惕-劳里碱,同时也是路易斯碱,因为O原子存在孤对电子。NH3也是路易斯碱。而HCl不是路易斯酸,因为它没有可容纳电子的空轨道。但我们可以将HCl视为H+,H+是一种路易斯酸。质子化过程可看成H+与电子对形成配位共价键。
缺电子的物质是路易斯酸,路易斯酸和路易斯碱形成配位键后得到八隅体结构。例如BF3和NH3的反应:


煤电厂使用生石灰(CaO)吸收尾气中的二氧化硫,减少环境污染。该反应属于路易斯酸碱反应,路易斯酸碱反应可以在所有的物质状态下发生。


路易斯酸碱理论的另一个重要应用涉及络离子的形成。络离子是多原子离子,包含一个或更多的中心金属离子,其他离子或小分子连接到金属离子上。很多金属离子在水溶液中以水合金属离子的形式存在,此时水作路易斯碱,金属离子作路易斯酸。水分子通过配位键与金属离子键合。因此无水AlCl3溶于水,将会形成水合铝离子[Al(H2O)6]3+(aq)。


水分子和金属形成的配位键很强,盐从溶液中结晶时,水分子仍然和金属离子保持配位,形成水合盐AlCl3·6H2O。水溶液中,水合金属离子可表现为布仑斯惕-劳里酸,例如Al3+的水解反应方程式如下:
水合金属离子中,水分子O—H键减弱。因为水分子与金属离子形成配位键时,金属离子吸引电子密度,减少了O—H键处的电子密度。因此配位的H2O可以向溶剂中的H2O提供H+;水分子电离后变为OH−,仍然与Al3+相连;络离子的电荷从+3减少到+2。[Al(H2O)6]3+的酸性与乙酸差不多。很多金属离子都可以水解,尤其是过渡金属离子。
过渡金属离子也可与其他路易斯碱(如NH3)形成络离子。例如Zn2+和NH3络合形成Zn(NH3)42+。路易斯酸Zn2+作为中心离子接受路易斯碱NH3的电子,形成配位键。我们会在24章进一步了解配合物。
例题
指出下列反应的Lewis酸和Lewis碱:
(a) BF3 + F− → BF4−
(b) OH−(aq) + CO2(aq) → HCO3−
解答
BF3是路易斯酸,F−是路易斯碱。CO2是路易斯酸,OH−是路易斯碱。
练习
指出下列反应的Lewis酸和Lewis碱:
(a) SnCl4 + 2 Cl− → [SnCl6]2−
(b) BF3 + NH3 → F3BNH3
